Реакции замещения
При
реакциях замещения обычно простое
вещество взаимодействует со сложным,
образуя другое простое вещество и
другое сложное:
А
+ ВС = АВ + С.
Эти
реакции в подавляющем большинстве
принадлежат к окислительно-восстановительным:
2Аl
+ Fe 2 O 3 =
2Fе + Аl 2 О 3 ,
Zn
+ 2НСl = ZnСl 2 +
Н 2 ,
2КВr
+ Сl 2 =
2КСl + Вr 2 ,
2КСlO 3 +
l 2 =
2KlO 3 +
Сl 2 .
Примеры
реакций замещения, не сопровождающихся
изменением валентных состояний атомов,
крайне немногочисленны. Следует отметить
реакцию двуокиси кремния с солями
кислородсодержащих кислот, которым
отвечают газообразные или летучие
ангидриды:
СаСО 3 +
SiO 2 =
СаSiO 3 +
СО 2 ,
Са 3 (РО 4) 2 +
ЗSiO 2 =
ЗСаSiO 3 +
Р 2 О 5 ,
Иногда
эти реакции рассматривают как реакции
обмена:
СН 4 +
Сl 2 =
СН 3 Сl
+ НСl.
Классификация по тепловому эффекту
эндотермическая реакция
экзотермическая реакция
Все химические реакции протекают с выделением или поглощением теплоты
По тепловому эффекту все реакции делят на два вида:
Экзотермические реакции
Например, реакция горения этана:
2 С2Н6 + 7О2 ⇒ 4СО2 + 6Н2О + Q
К реакциям, идущим с выделением теплоты (экзотермическим), кроме реакций горения, относятся почти все реакции соединения (исключение реакция азота с кислородом с образованием оксида азота (II) — эндотермическая: N2 + O2 = 2NO –Q), реакции сопровождающиеся взрывом, разложения дихромата аммония, образования аммиака: N2 + 3H2 ⇒ 2NH3 , реакции нейтрализации, алюмотермия, синтез аммиака, и реакции в которых из менее стабильных веществ образуются более стабильные
Экзотермические реакции, в процессе протекания которых выделяется свет, называют реакциями горения. Например, реакция горения пропана:
С3Н8 + 5О2 ⇒ 3СО2 + 4Н2О + Q
Эндотермические
Например, реакция разложения малахита:
Cu2CO3 (OH)2 → CuO + CO2 + H2O — Q
Например: H2 + Cl2 = 2HCl + 184,6 кДЖ. В термохимических уравнениях вместо стрелки ставят знак равенства.
Определение процесса
Процесс протекания химической реакции представляет собой изменение состояния вещества, вызванное взаимодействием химических реактивов. В результате такого взаимодействия происходят изменения в химичесном составе реагирующих веществ, а также в их физических свойствах.
Протекание химической реакции может сопровождаться различными процессами, такими как образование новых соединений, разрушение или превращение исходных веществ, изменение цвета или запаха и другими явлениями.
Химические реакции происходят всегда с определенной скоростью и под определенными условиями, такими как температура, давление, наличие катализаторов и других факторов. Кроме того, протекание химической реакции может зависеть от концентрации реагирующих веществ и их соотношения.
Изучение процессов, сопровождающих химические реакции, позволяет понять и описать механизмы этих реакций, исследовать их энергетические характеристики и прогнозировать их результаты. Знание протекания химических реакций имеет огромное значение в различных областях науки и техники, включая химию, биологию, медицину, материаловедение и другие.
Условия протекания, что провоцирует
Факторы, влияющие на скорость протекания химических реакций:
- природа веществ, вступающих в реакцию (например, натрий активно реагирует с водой с воспламенением, а кальций спокойно);
- концентрация исходных веществ (например, цинк с концентрированной соляной кислотой будет реагировать быстрее, чем с разбавленной);
- температура (с повышением температуры скорость большинства химических реакций возрастает);
- давление для реакций с участием газообразных веществ (увеличение давления приводит к возрастанию скорости реакции);
- наличие катализатора (катализаторы ускоряют химические реакции);
- поверхность соприкосновения реагирующих веществ (измельченные порошкообразные вещества реагируют быстрее, чем вещества в форме крупных кусков);
- характер растворителя;
- световое облучение, ионизирующее излучение и пр. (инициируют или ускоряют протекание реакций).
Зависимость скорости от концентрации веществ в растворах (смесях), вступающих во взаимодействие, изучалась учеными с XIX века. Норвежцы К.Гульдберг и П. Вааге (1867 г.) открыли кинетический закон действующих масс для простых реакций (протекающих в одну стадию). Он формулируется следующим образом:
для реакции
Влияние температуры на скорость реакции связано с понятием энергии активации — это избыточная энергия, которую должна приобрести частица, чтобы вступить в химическую реакцию. С повышением температуры возрастает доля частиц, обладающих энергией, значение которой превышает пороговую величину энергии активации. Поэтому большее число частиц вступает в химическую реакцию, скорость реакции возрастает.
На скорость протекания реакций в газообразном состоянии влияет давление. Увеличение давления p аналогично уменьшению объема V, так как эти величины обратно пропорциональны. Эту зависимость выражает уравнение Менделеева-Клайперона:
возрастает с уменьшением объема, то увеличение давления аналогично повышению концентрации. При повышении давления скорость химической реакции возрастает.
Действенным решением для увеличения скорости реакции является применение катализатора. Он увеличивает скорость реакции, при этом сам в процессе реакции не расходуется, его количество и состав остаются без изменения. Примерную схему реакции с участием катализатора представляют так:
Существуют гомогенный и гетерогенный катализ. При гомогенном катализе катализатор находится в том же агрегатном состоянии, что и исходные вещества. При гетерогенном катализе катализатор и исходные веществ находятся в разных агрегатных состояниях.
Биохимические реакции, протекающие в организме животных и человека, протекают с участием естественных катализаторов — ферментов. Их действие очень специфично и зависит от состояния здоровья органов и систем. Ферменты обладают высокой чувствительностью к кислотности внутренней среды, гипертермии, воздействию ряда медикаментозных средств и т.п.
Уравнения химических реакций
Согласно закону сохранения массы исходная масса продуктов всегда равна массе полученных реагентов. Количество атомов элементов до и после реакции всегда одинаковое, атомы только перегруппировываются и образуют новые вещества. Вернемся к схемам реакций, записанным ранее:
В данных схемах реакций знак «→» можно заменить на знак «=», так как видно, что количество атомов до и после реакций одинаковое. Записи будут иметь следующий вид:
Именно такие записи называют уравнениями химических реакций, то есть, это – записи схем реакций, в которых количество атомов до и после реакции одинаковое.
Уравнение химической реакции – условная запись химической реакции посредством химических формул, которая соответствует закону сохранения массы вещества
Если мы рассмотрим другие, приведенные ранее схемы уравнений, можно заметить, что на первый взгляд, закон сохранения массы в них не выполняется:
Видно, что в левой части схемы, атом углерода один, а в правой – их два. Атомов водорода поровну и в левой и правой частях их по четыре. Превратим данную схему в уравнение. Для этого необходимо уравнять количество атомов углерода. Уравнивают химические реакции при помощи коэффициентов, которые записывают перед формулами веществ. Очевидно, чтобы количество атомов углерода стало одинаковым слева и справа, в левой части схемы, перед формулой метана, необходимо поставить коэффициент 2:
Видно, что атомов углерода слева и справа теперь поровну, по два. Но теперь неодинаково количество атомов водорода. В левой части уравнения их 2∙4 = 8. В правой части уравнения атомов водорода 4 (два из них в молекуле ацетилена, и еще два – в молекуле водорода). Если поставить коэффициент перед ацетиленом, нарушится равенство атомов углерода. Поставим перед молекулой водорода коэффициент 3:
Теперь количество атомов углерода и водорода в обеих частях уравнения одинаковое. Закон сохранения массы выполняется! Рассмотрим другой пример. Схему реакции Na + H2O → NaOH + H2 необходимо превратить в уравнение. В данной схеме различным является количество атомов водорода. В левой части два, а в правой – три атома. Поставим коэффициент 2 перед NaOH.
Тогда атомов водорода в правой части станет четыре, следовательно, коэффициент 2 необходимо добавить и перед формулой воды:
Уравняем и количество атомов натрия:
Теперь количество всех атомов до и после реакции одинаковое. Таким образом, можно сделать вывод: чтобы превратить схему химической реакции в уравнение химической реакции, необходимо уравнять количество всех атомов, входящих в состав реагентов и продуктов реакции при помощи коэффициентов. Коэффициенты ставятся перед формулами веществ. Подведем итоги об Уравнения химических реакций
- Схема химической реакции – условная запись, показывающая, какие вещества вступают в реакцию, какие продукты реакции образуются, а также условия протекания реакции
- В схемах реакций используют обозначения, указывающие на особенности их протекания
- Уравнение химической реакции – условная запись химической реакции посредством химических формул, которая соответствует закону сохранения массы вещества
- Схему химической реакции превращают в уравнение путем расстановки коэффициентов перед формулами веществ
Влияние на равновесную систему
С химическим равновесием разобрались, теперь двигаемся дальше.
Что будет, если на нашу идеальную равновесную систему оказать какое-либо влияние?
Произойдет смещение, то есть сдвиг равновесия – нарушение химического равновесия за счет преобладания скорости прямой или обратной реакции.
На химическое равновесие будет влиять несколько факторов:
- температура,
- давление и объем,
- концентрация реагента или продукта.
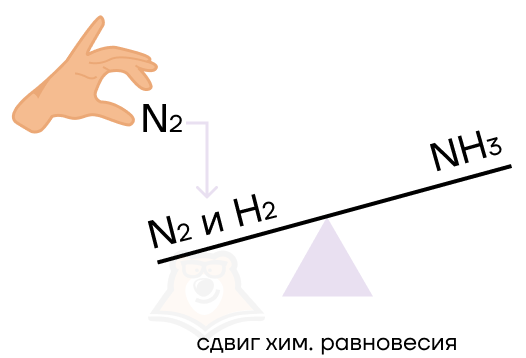
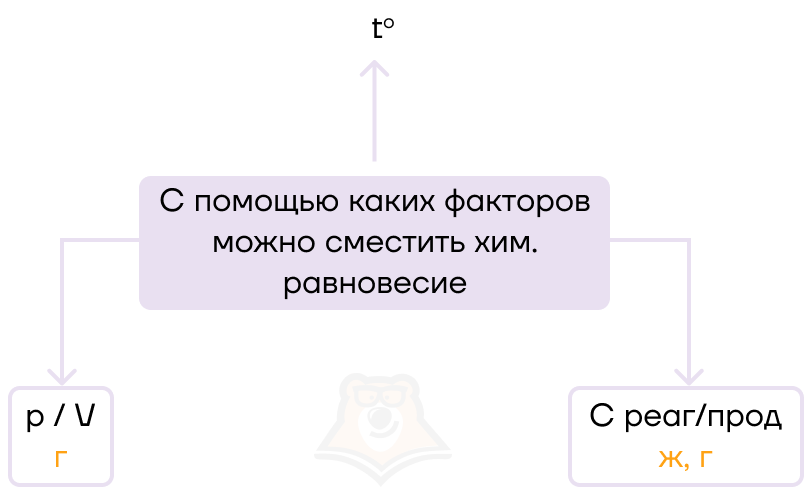
Как же определить, как именно какое-то воздействие повлияет на химическое равновесие? Здесь нам поможет волшебное правило Ле Шателье. Согласно ему при действии на систему, которая находится в равновесии, равновесие смещается в ту сторону, которая будет ослаблять воздействие.
То есть система, как капризный ребёнок, всё делает наоборот. Действие, которое будут оказывать на него, будет вызывать кучу криков и споров, то есть противодействие.
Теперь давайте углубимся в факторы, которые влияют на равновесие
Важно понимать, что может вывести систему из себя.
- Температура
Мы уже знаем, что по тепловому эффекту реакции делят на экзо- и эндотермические.
Подробнее об этом можно прочитать в следующей статье: «Электролитическая диссоциация электролитов в водных растворах».
Так как согласно правилу Ле Шателье система нам всегда противодействует, то:
- при повышении температуры (+) равновесие будет смещаться в сторону эндотермической реакции (-);
- при понижении температуры (-) – в сторону экзотермической реакции (+).
Подробнее про типы химических реакций можно прочитать в статье «Химические реакции по тепловому эффекту».
Рассмотрим теперь это на примере:
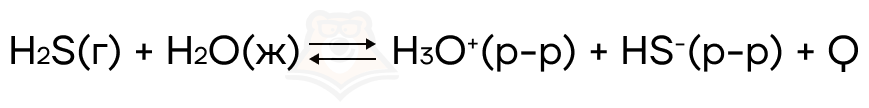
При увеличении температуры, равновесие такой реакции будет смещаться в сторону обратной реакции, так как именно в ту сторону будет идти эндотермическая реакция.
А при уменьшении температуры, равновесие сместится в сторону прямой реакции, так как там происходит экзотермическая реакция.
- Концентрация
Опять же вспоминаем, что система – вредный ребенок, который всё делает наоборот. Поэтому при добавлении какого-либо вещества (повышении концентрации) она старается поскорее его израсходовать, а при уменьшении концентрации (разбавлении) наоборот – экономить и забирать это вещество себе.
То есть при повышении концентрации реагентов и понижении концентрации продуктов происходит сдвиг равновесия в сторону продуктов, а при понижении концентрации реагентов и повышении концентрации продуктов равновесием смещается в сторону реагентов.
Рассмотрим теперь это на примере:
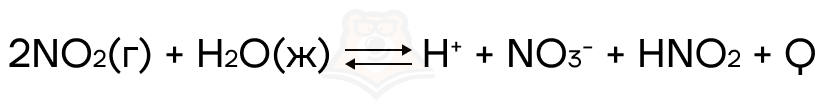
Что произойдет при увеличении концентрации азотистой кислоты?
Увеличится концентрация продукта, следовательно равновесие сместится в сторону реагентов.
Важно! Добавление твердых нерастворимых веществ не оказывает влияния на смещение равновесия. Однако при добавлении твердых растворимых веществ смещение может происходить, так как в воде растворимые вещества диссоциируют на ионы, то есть распадаются на заряженные частицы
Однако при добавлении твердых растворимых веществ смещение может происходить, так как в воде растворимые вещества диссоциируют на ионы, то есть распадаются на заряженные частицы.
Например:
- Давление (только для газов)
Правило “сделай наоборот” работает и для этого фактора. При увеличении давления равновесие смещается в сторону меньших объемов газов, а при уменьшении давления – в сторону больших объемов газов.
Как посчитать эти объемы газов?
Легко! Просто считаем сколько всего моль газов и в продуктах и в реагентах, где количество вещества больше, там и объем больше!
Рассмотрим на примере:
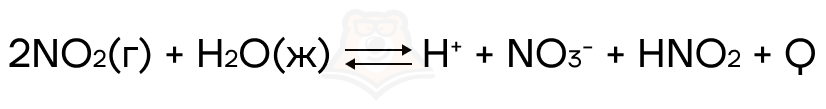
Что произойдёт при увеличении давления?
Считаем газы (в реагентах 2 моль, в продуктах 0 моль), поэтому равновесие сместится в сторону продуктов.
Важно! Давление и объем обратно пропорциональны, поэтому увеличение давления = уменьшение объема, а уменьшение давления = увеличение объема
| Может ли “такси” сместить химическое равновесие?Какое такси? Мы говорим о катализаторе, который разгоняет скорость химической реакции. Он и является “такси” в химии.Подробнее про это можно почитать в статье: «Скорость химической реакции».Так вот, несмотря на то, что катализатор влияет на скорость реакции, на смещение равновесия он влиять не будет! Так что его “услуги” тут не будут работать. |
Страницы
(Переместить в …)
Главная страницаОСНОВЫ ОБЩЕЙ ХИМИИ1.1 Важнейшие классы неорганических веществ2.1 Вещества. Атомы2.2 Размеры атомов2.3 Молекулы. Химические формулы2.4 Простые и сложные вещества2.5 Валентность элементов2.6 Моль. Молярная масса2.7 Закон Авогадро2.8 Закон сохранения массы веществ2.9 Вывод химических формул3.1 Строение атома. Химическая связь3.2 Строение атома3.4 Строение электронной оболочки атома3.5 Периодическая система химических элементов3.6 Зависимость свойств элементов3.7 Химическая связь и строение вещества3.8 Гибридизация орбиталей3.9 Донорно-акцепторный механизм образования3.10 Степени окисления элементов4.1 Классификация химических реакций4.2 Тепловые эффекты реакций4.3 Скорость химических реакций4.4 Необратимые и обратимые реакции4.5 Общая классификация химических реакцийНЕОРГАНИЧЕСКАЯ ХИМИЯ5.1 Растворы. Электролитическая диссоциация5.2 Количественная характеристика состава растворов5.3 Электролитическая диссоциация5.4 Диссоциация кислот, оснований и солей5.5 Диссоциация воды5.6 Реакции обмена в водных растворах электролитов5.7 Гидролиз солей6.1 Важнейшие классы неорганических веществ6.2 Кислоты, их свойства и получение6.3 Амфотерные гидроксиды6.4 Соли, их свойства и получение6.5 Генетическая связь между важнейшими классами6.6 Понятие о двойных солях7.1 Металлы и их соединения7.2 Электролиз7.3 Общая характеристика металлов7.4 Металлы главных подгрупп I и II групп7.5 Алюминий7.6 Железо7.7 Хром7.8 Важнейшие соединения марганца и меди8.1 Неметаллы и их неорганические соединения8.2 Водород, его получение8.3 Галогены. Хлор8.4 Халькогены. Кислород8.5 Сера и ее важнейшие соединения8.6 Азот. Аммиак. Соли аммония8.7 Оксиды азота. Азотная кислота8.8 Фосфор и его соединения8.9 Углерод и его важнейшие соединения8.10 Кремний и его важнейшие соединенияОРГАНИЧЕСКАЯ ХИМИЯ9.1 Основные положения органической химии. Углеводороды9.2 Электронные эффекты заместителей в органических соединениях9.3 Предельные углеводороды (алканы)9.3.1 Насыщенные УВ. Метан9.4 Понятие о циклоалканах9.5 Непредельные углеводороды9.6 Диеновые углеводороды (алкадиены)9.7 Алкины9.8 Ароматические углеводороды9.9 Природные источники углеводородов10.1 Кислородсодержащие органические соединения10.2 Фенолы10.3 Альдегиды10.4 Карбоновые кислоты10.5 Сложные эфиры. Жиры10.6 Понятие о поверхностно-активных веществах10.7 Углеводы11.1 Амины. Аминокислоты11.2 Белки11.3 Понятие о гетероциклических соединениях11.4 Нуклеиновые кислоты12.1 Высокомолекулярные соединения12.2 Синтетические волокна▼
Скорость химической реакции
Под скоростью химической реакции обычно понимают изменение количества одного из реагирующих веществ за единицу времени. Притом, скорость химической реакции всегда положительная величина. В 1865 году химиком Н. Н. Бекетовым был сформулирован закон действия масс гласящий, что «скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам».
К факторам скорости химической реакции можно отнести:
- природу реагирующих веществ,
- наличие катализатора,
- температуру,
- давление,
- площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.
Реакции разложения
Реакции
разложения приводят к образованию
нескольких соединений из одного сложного
вещества:
А
= В + С + D.
Продуктами
разложения сложного вещества могут
быть как простые, так и сложные вещества.
Из
реакций разложения, протекающих без
изменения валентных состояний, следует
отметить разложение кристаллогидратов,
оснований, кислот и солей кислородсодержащих
кислот:
|
CuSO 4 + |
|
2H 2 O |
2AgNO 3 =
2Ag + 2NO 2 +
O 2 ,
(NH 4)2Cr 2 O 7 =
Cr 2 O 3 +
N 2 +
4H 2 O.
Особенно
характерны окислительно-восстановительные
реакции разложения для солей азотной
кислоты.
Реакции
разложения в органической химии носят
название крекинга:
С 18 H 38 =
С 9 H 18 +
С 9 H 20 ,
или дегидрирования
C 4 H 10 =
C 4 H 6 +
2H 2 .
Классификация химических реакций
На рисунке видно, что классификация химических реакций составлена на основании конкретных признаков. Так, по числу вступивших в реакцию и образовавшихся веществ они бывают реакциями соединения, разложения, замещения и обмена. Реакции, в которых происходит изменение степеней окисления атомов элементов, называются окислительно-восстановительными. Реакции, протекающие без изменения степеней окисления, называются неокислительно-восстановительными.
В зависимости от того, идет ли реакция с выделением либо с поглощением энергии (тепла), существует деление на экзо- и эндотермические реакции.
В зависимости от участвующих компонентов, химические реакции могут иметь обратимый либо необратимый характер. Необратимые реакции протекают только в одном направлении, обратимые — в прямом и обратном направлении. При соответствующих условиях полученные вещества могут преобразоваться обратно, в первичные продукты. В отдельных случаях из двух растворенных веществ может синтезироваться нерастворимый продукт. Тогда реакция становится необратимой. Еще одним примером необратимого процесса является сгорание углеводородного топлива (в присутствии кислорода из атмосферы). В результате него выделяется тепловая и световая энергия, а также образуется углекислый газ и .
По наличию катализатора (вещества, которое изменяет скорость реакции, но при этом само не расходуется), реакции делятся на каталитические и некаталитические.
Рассмотрим более детально деление реакций по числу и составу веществ, вступающих во взаимодействие и получившихся в результате него:
По изменению степеней окисления реакции бывают: 1. С изменением степени окисления (происходит переход электронов от одного атома к другому):
2. Без изменения степени окисления. В этом случае каждый атом в конце реакции имеет ту же степень окисления, что и в начале:
Характеристика по тепловому эффекту:
Реакция с поглощением тепла (эндотермическая реакция):
В ходе данного взаимодействия поглощается 90,4 кДж тепла. -90,4 кДж — тепловой эффект реакции.
Реакция с выделением тепла (экзотермическая реакция):
В этой реакции выделяется 92,3 кДж тепла.
Следующим важным принципом классификации является критерий обратимости либо необратимости взаимодействия. Рассмотрим таблицу:
В уравнениях необратимых реакций используют стрелку →, для обратимых .
В химии существует ряд условий, при наличии которых реакция считается необратимой. Они отражены в таблице:
В случае обратимых реакций под воздействием внешних факторов (изменение концентрации веществ, температуры, давления) соотношение скоростей прямой и обратной реакций могут изменяться. Если скорость прямой реакции выше, чем обратной, в реакционной системе преобладают продукты реакции. В этом случае говорят, что равновесие смещено в сторону прямой реакции (вправо). Если скорость обратной реакции выше, и в системе преобладают исходные вещества, говорят, что равновесие смещено в сторону обратной реакции (влево). Факторы, влияющие на положение равновесия, перечислены в таблице.
Широко распространены реакции, которые с заметной скоростью протекают только в присутствии катализаторов — каталитические реакции. Большинство реакций, протекающих в живых организмах, происходят с участием ферментов (природных катализаторов). Используемая в гигиенических и санитарных мероприятиях перекись водорода (в концентрации 3%) является относительно устойчивым веществом. Однако при контакте с распадается на воду и кислород. В данном примере диоксид марганца является катализатором химической реакции разложения пероксида водорода.
Важные факторы, влияющие на протекание химических реакций
1. Концентрация реагентов: Чем выше концентрация реагентов, тем больше частиц, возможных для столкновения, и тем выше вероятность, что произойдет успешная реакция. Поэтому повышение концентрации реагентов увеличивает скорость протекания реакции.
2. Температура: Повышение температуры ускоряет молекулярные движения частиц, что приводит к более частым и энергичным столкновениям. Значительное повышение температуры может даже изменить характер реакции. Увеличение температуры обычно увеличивает скорость протекания реакции.
3. Катализаторы: Катализаторы – вещества, которые повышают скорость реакции, участвуя в ней и затем восстанавливаясь в исходное состояние. Они снижают энергию активации реакции, делая ее процесс более эффективным.
4. Размер частиц реагентов: Мелкие частицы реагируют быстрее, так как у них больше поверхности для столкновений. При уменьшении размера частиц увеличивается их активность, что приводит к увеличению скорости реакции.
5. Растворитель: В некоторых случаях добавление растворителя может ускорить реакцию, облегчая смешение реагентов и увеличивая поверхность контакта.
6. Давление: Для реакций в газовой фазе изменение давления может оказывать влияние на скорость и протекание реакций. Высокое давление обычно увеличивает частоту столкновений и, следовательно, ускоряет реакцию.
Учет и оптимальное использование этих факторов позволяют контролировать скорость протекания химических реакций, что является важным для множества прикладных и научных задач.
7. Заключение
8. Рекомендуемая
литература
ВВЕДЕНИЕ
Термодинамический метод изучения химических
реакций позволяет сделать вывод о принципиальной возможности исследуемого
процесса в тех или иных условиях и о глубине его протекания.
При постоянстве давления и температуры
самопроизвольное протекание процесса возможно только в направлении уменьшения
энергии Гиббса.
Условие определяет принципиальную возможность
проведения процесса в заданных условиях из начального состояния в конечное, но
не позволяет оценить скорость такого перехода.
Это обстоятельство связано с тем, что реакции не зависит от
пути (механизма) процесса, а определяется только начальным и конечным
состоянием системы.
Однако химические реакции могут протекать с
самыми различными скоростями – от взрывных до очень медленных, протекающих в
течение многих месяцев и лет. Даже одна и та же реакция, протекающая на различных
катализаторах, может иметь скорости, различающиеся во много раз.
В некоторых случаях необходимо увеличить
скорость реакции, в других наоборот, уменьшить. Таких примеров можно привести
множество.
Поэтому изучение скорости протекания химических
процессов (а это и составляет задачу кинетики) чрезвычайно важно. Для рационального проведения химических реакций
необходимо уметь управлять ими, знать зависимости скорости от различных параметров
Для рационального проведения химических реакций
необходимо уметь управлять ими, знать зависимости скорости от различных параметров.
По кинетике издано очень
много учебной и методической литературы. Но все эти книги и учебные пособия
написаны так, что хочется спросить: «Какое, милые, тысячелетье на дворе?»
Современные системы компьютерной математики позволяют дать быстрый, и что,
пожалуй, главное, наглядный прогноз относительно поведения химической системы
во времени.
Однако в русскоязычной учебной литературе по
кинетике химических реакций подход, в котором используются средства символьной
математики в совокупности со средствами решения систем дифференциальных уравнений,
представляемые математическим пакетом Mathcad, практически отсутствует.
Поэтому, отвечая на естественный вопрос – чем предлагаемое
учебное пособие отличается от множества других, можно ответить: настоящее пособие
имеет цель продемонстрировать эффективность применения математического пакета Mathcad для решения задач
химической кинетики.
Специальные
химические дисциплины, такие как термодинамика и кинетика, достаточно
математизированы, и часто решение химической задачи вызывает у студентов
значительные трудности, связанные с математикой – довольно часто это приводит к
тому, что приходится сознательно упрощать задачу.
Пособие иллюстрирует богатейшие возможности, которые открывает применение
компьютерной математики перед исследователем для анализа поведения химических
систем во времени.
В этом отношении математические пакеты становятся практически незаменимыми
элементами обучения, позволяющими сделать акцент на содержательном анализе
полученных результатов.
Знаком >>>>>>
в тексте пособия отмечен переход к Mathcad документу для
интерактивного расчета.
1. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ КИНЕТИКИ





























