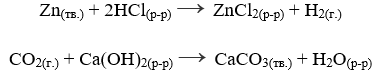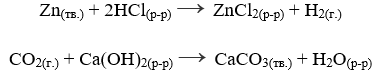Уравнения химических реакций
Согласно закону сохранения массы исходная масса продуктов всегда равна массе полученных реагентов. Количество атомов элементов до и после реакции всегда одинаковое, атомы только перегруппировываются и образуют новые вещества. Вернемся к схемам реакций, записанным ранее:
В данных схемах реакций знак «→» можно заменить на знак «=», так как видно, что количество атомов до и после реакций одинаковое. Записи будут иметь следующий вид:
Именно такие записи называют уравнениями химических реакций, то есть, это – записи схем реакций, в которых количество атомов до и после реакции одинаковое.
Уравнение химической реакции – условная запись химической реакции посредством химических формул, которая соответствует закону сохранения массы вещества
Если мы рассмотрим другие, приведенные ранее схемы уравнений, можно заметить, что на первый взгляд, закон сохранения массы в них не выполняется:
Видно, что в левой части схемы, атом углерода один, а в правой – их два. Атомов водорода поровну и в левой и правой частях их по четыре. Превратим данную схему в уравнение. Для этого необходимо уравнять количество атомов углерода. Уравнивают химические реакции при помощи коэффициентов, которые записывают перед формулами веществ. Очевидно, чтобы количество атомов углерода стало одинаковым слева и справа, в левой части схемы, перед формулой метана, необходимо поставить коэффициент 2:
Видно, что атомов углерода слева и справа теперь поровну, по два. Но теперь неодинаково количество атомов водорода. В левой части уравнения их 2∙4 = 8. В правой части уравнения атомов водорода 4 (два из них в молекуле ацетилена, и еще два – в молекуле водорода). Если поставить коэффициент перед ацетиленом, нарушится равенство атомов углерода. Поставим перед молекулой водорода коэффициент 3:
Теперь количество атомов углерода и водорода в обеих частях уравнения одинаковое. Закон сохранения массы выполняется! Рассмотрим другой пример. Схему реакции Na + H2O → NaOH + H2 необходимо превратить в уравнение. В данной схеме различным является количество атомов водорода. В левой части два, а в правой – три атома. Поставим коэффициент 2 перед NaOH.
Тогда атомов водорода в правой части станет четыре, следовательно, коэффициент 2 необходимо добавить и перед формулой воды:
Уравняем и количество атомов натрия:
Теперь количество всех атомов до и после реакции одинаковое. Таким образом, можно сделать вывод: чтобы превратить схему химической реакции в уравнение химической реакции, необходимо уравнять количество всех атомов, входящих в состав реагентов и продуктов реакции при помощи коэффициентов. Коэффициенты ставятся перед формулами веществ. Подведем итоги об Уравнения химических реакций
- Схема химической реакции – условная запись, показывающая, какие вещества вступают в реакцию, какие продукты реакции образуются, а также условия протекания реакции
- В схемах реакций используют обозначения, указывающие на особенности их протекания
- Уравнение химической реакции – условная запись химической реакции посредством химических формул, которая соответствует закону сохранения массы вещества
- Схему химической реакции превращают в уравнение путем расстановки коэффициентов перед формулами веществ
Классификация по числу и составу исходных и образующихся веществ
Реакции, идущие без изменения состава веществ
Химических реакций, идущих без изменения числа и состава исходных веществ и продуктов реакции не так много. В неорганической химии — это реакции образования простых веществ (аллотропных модификаций) одним и тем же элементом, с разным строением и свойствами,
например: S8 ромбическая → S8 моноклинная
В органической химии к таким реакциям относятся реакции перестройки углеродных цепей (изомеризация), когда из одного вещества под действием определенных условий, создаваемых для реакции(температура, применение катализатора), образуется вещество с другой структурой, но тем же составом — изомер.
Например, образование из бутана изобутана (2-метилпропана):
CH3-CH2-CH2-CH3 ⇒ CH3-CH(CH3)-CH3
Реакции с изменением состава веществ
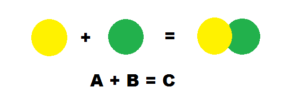
- схема реакции соединения
В неорганической химии к реакциям соединения относятся
В органической химии подобные реакции называются реакциями присоединения
гидрирования (присоединение водорода)
СН2=СН2 + Н2 ⇒ СН3 — СН3
галогенирования (присоединение галогенов: хлор, бром, йод)
СН2=СН2 + Сl2 ⇒ СН2Сl — СН2Сl
гидрогалогенирования (присоединение галогеноводородов — НГаl)
СН2=СН2 + НСl ⇒ СН3 — СН2Сl
гидратации (присоединение воды)
СН2=СН2 + Н2О ⇒ СН3 — СН2ОН
полимеризации (присоединение молекул друг к другу при наличии в них кратных связей)
nСН2=СН2 + СН2 = СН2 ⇒ ( — СН2 — СН2 -)n (реакция получения полиэтилена)
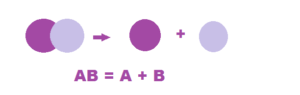
- схема реакции разложения
Реакции разложения в органической химии разделяют на собственно реакции разложения, которые происходят с разрывом углеродной цепи и реакции отщепления.
Реакции отщепления или элиминирования — это реакции, в процессе которых от исходной молекулы отрываются атомы или или группы атомов, а углеродный скелет молекулы сохраняется. В названии таких реакций используют приставку «де».
Например реакция дегидрирования пропана: СН3 — СН2 — СН3 ⇒ СН2 = СН — СН3 + Н2
Пример реакции разложения (крекинга) гексана C6H14 ⇒ С3Н8 + С3Н6
В реакциях разложения (термического расщепления) органических веществ происходит разрыв углеродной цепи молекулы на более короткие цепочки. Такие реакции протекают в жестких условиях при высокой температуре (400-500 ºС) и в присутствии катализатора. Этот процесс является важнейшей стадией переработки углеводородов.
- схема реакции замещения
Пример реакции взаимодействия соляной кислоты с цинком: 2НСl + Zn ⇒ ZnCl2 + H2
Замещаться могут не только отдельные атомы, но и молекулы
Например, при сплавлении оксидов с солями, менее летучие оксиды вытесняют более летучие из солей. Так, нелетучий оксид кремния вытесняет оксид серы (IV) из сульфита натрия при сплавлении:
Например, реакция хлорирования метана: CH4 + Cl2 ⇒ CH3Cl + HCl
По числу исходных частиц и составу продуктов эта реакция больше похожа на реакцию обмена, но по механизму такая реакция является реакцией замещения
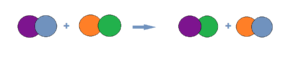
- схема реакции обмена AB + CD = AC + ВD
Например:Fe2(SO4)3 + 3BaCl2 ⇒ 3BaSO4↓ + 2FeCl3
В неорганической химии большинство реакций обмена протекают в растворах электролитов между ионами и поэтому их называют реакциями ионного обмена или ионными реакциями
Реакции ионного обмена идут до конца в трех случаях:
Образование осадка:
Fe2(SO4)3 + 3BaCl2 ⇒ 3BaSO4↓ + 2FeCl3 (уравнение в молекулярном виде)
Ионные уравнения : 2Fe3+ + 3SO42- + 3Ba2+ + 6Cl— → 3BaSO4 ↓ + 2Fe3++ 6Cl— (полное)
3Ba2+ + 3SO42- → 3BaSO4 (сокращенное)
Образование газообразного вещества
Образование малодиссоциирующего вещества — воды
NaOH + HNO3 ⇒ NaNO3 + H2O (молекулярное)
Ионные: Na++OH— + H++ NO3— ⇒ Na+ + NO3— + H2O (полное)
H+ +OH— ⇒ H2O (сокращенное)
I. Систематизация реакций в химии неорганических веществ. Примеры
- В процессе окисления-восстановления меняется степень окисления химических элементов:
Al + S → Al2+3S3-2
В этом примере к атому серы присоединяются два электрона – это полуреакция восстановления. Окислительная степень её сменилась с 0 до -2.
Сера здесь – окислитель (акцептор электронов).
Атом алюминия, отдав 3 электрона, изменил степень окисления с 0 до +3 и стал восстановителем (донором электронов). Это окислительная полуреакция.
Обе полуреакции составляют единый окислительно-восстановительный процесс.
- При проведении реакции соединения несколько реагентов образуют только один продукт:
4NO2 +O2 +2H2O=4HNO3
-
Разложение наоборот продуцирует из одного химического реагента два или несколько других:
CaCO3 = CaO + CO2
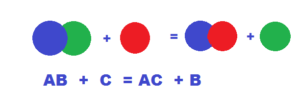
- Взаимодействие простого и сложного вещества, которое ведёт к образованию других простых и сложных веществ, называется реакцией замещения:
Zn + CuSO4 = ZnSO4 + Cu
-
В обменной реакции участвующие в ней реагенты меняются своими структурными частями:
2NaOH + CuCl2 = 2NaCl + Cu(OH)2
Частным случаем этого процесса является нейтрализация между собой кислот и оснований:
KOH + HCl = KCl + H2O
- Классифицирующий признак «направление реакции» разделяет их на необратимые и обратимые. Если в ходе необратимой процесс идёт только в одном направлении до получения конечных продуктов, то в обратимой реакции он протекает в прямом и противоположном направлениях:
3H2 + N2 ⇆ 2NH3 – обратимая реакция,
- Преобразование веществ обязательно сопровождается разрывом связей в молекулах и созданием новых.
Если этот разрыв сопровождается образованием радикалов, что присуще молекулам с неполярными и малополярными ковалентными связями, то этот процесс — гомолитическая реакция:
Cl2свет→ Cl∙ + ∙Cl
Каждая частица хлора, обладая неспаренным электроном, превращается в радикал. Реакции, связанные с разрывом сильнополярных связей и образованием заряженных частиц – ионов, являются гетеролитическими:
HBr ⇆H+ +Br–
- Любое химическое превращение – это энергетический процесс. Поэтому ещё один показатель химического реагирования – тепловой эффект.
Реакции, идущие с выделением тепловой энергии, называются экзотермическими. Практически все реакции соединения – экзотермические.
Если им ещё сопутствует световое излучение, то такая реакция носит название горение.
C + O2 = CO2 + Q, где Q – тепловой эффект.
Взаимодействие веществ с поглощением тепла эндотермическая реакция. К такому типу относятся реакции разложения:
CaCO3 → CaO + CO2 – Q
Для сведения. Уравнения, демонстрирующие тепловой эффект (Q), носят название термохимические.
- Группа гомогенных и гетерогенных реагирований определяется фазным (агрегатным) состоянием веществ.
В гомогенных – все исходные и полученные в ходе реакции вещества существуют в одной фазе. Например, в растворах, в газообразной среде:
NaOH(р-р) + HCl(р-р) = NaCl + H2O
2CO + O2 = 2CO2
Если реагенты и полученные продукты находятся в разных фазовых состояниях, то речь идёт о гетерогенном взаимодействии:
-
Большая группа реакций определяется участием в них особых веществ – катализаторов, т.е. соединений – ускорителей реакции.
Каталитические реакции идут только с их участием:
2H202MnO2→ 2H2O + O2 (катализатор MnO2)
Некаталитические реакции в присутствии катализаторов не нуждаются:
КOH + HCl → КCl + H2O
Для сведения. Существуют также вещества, которые замедляют химические реакции – ингибиторы. В ходе реакций ни катализаторы, ни ингибиторы не расходуются и не изменяются.
Классификация по результатам реакции
Присоединение
Присоединение характерно для непредельных органическихсоединений. В таких реакциях тройная связь превращается в двойную, а двойная в ординарную: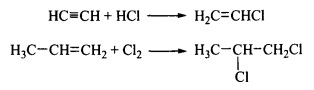
В реакциях присоединения ΔS отрицательно, так как возможности (степени свободы) трансляции уменьшаются. Величина ΔН также отрицательна. Реакции идут при умеренных температурах.
Реакции отщепления (элиминирования)
Элиминирование (отщепление) — процесс, обратный присоединению, в результате которого отщепляются простые или сложные вещества:
Очевидно, что ΔS положительно. Такие реакции возможны при достаточно высоких температурах, а отщепляются обычно термодинамически стабильные частицы (Н2O , СО, СO2 и др.).
Реакции замещения
Замещение. В реакциях этого типа атом или группа атомов в соединении замещаются на другой атом или группу атомов:
СН4 + Сl2 → СН3Сl + НСlСН3СН2Сl + Н2O → СН3СН2ОН + НСl
Реакции, в которых одним из реагентов является растворитель, называют сольволизом (гидролиз, алкоголиз, аммонолиз — соответственно вода, спирт, аммиак). Если в результате реакции замещения отщепляются вода, спирт, аммиак, то говорят о реакции конденсации:![]()
Общее число частиц в реакциях замещения не изменяется, то есть ΔS ≈ 0.
Перегруппировка, изомеризация.
В результате перегруппировки атомы или атомные группы внутри молекулы меняются местами, иногда без сохранения элементного состава, например при пинакон-пинаколиновой перегруппировке: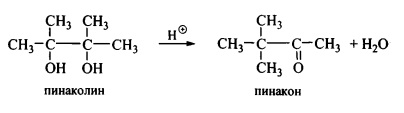
При изомеризации, частном случае перегруппировки элементный состав сохраняется.
Многие перегруппировки обратимы. Если структурные изомеры находятся в состоянии равновесия, то такие изомеры называются таутомерами, то есть таутомерия является частным случаем реакции изомеризации. На величину ΔS в таких реакциях более существенное влияние оказывает изменение степени свободы вращательного движения.
Окисление и восстановление.
Как и для неорганических, весьма распространенными для органических соединений являются окислительно-восстановительные реакции.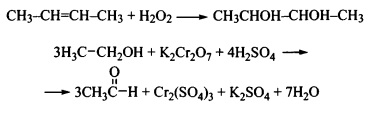
- Окисление — образование новых связей углерода с более электроотрицательными элементами (галогены, кислород, азот, сера, фосфор и др.), но обычно с кислородом.
- Восстановление — образование новых связей С—Н.
Классификация химических реакций на основании их признаков.
|
в результате таких реакций из двух или более исходных веществ образуется только один продукт, например: С + O2 = CO2 4NO2 + O2 + 2H2O = 4HNO3 |
|
|
в таких реакциях из одного вещества образуется два или больше других веществ: 2KMnO4 = K2MnO4 + MnO2 + O2 CaCO3 = CaO + CO2 |
|
замещенияВсе реакции, в результате которых из простого и сложного веществ образуется другое простое и другое сложное вещества. Например: Zn + CuSO4 = ZnSO4 + Cu В органической химии, под реакциями замещения подразумевают также такие реакции, в результате которых происходит замена атома водорода или заместителя прикрепленного к углеродному скелету молекулы, на другой заместитель. Подробнее — в таблице ниже посвященной классификации реакций в органической химии. |
|
обменаРеакциями обмена называют такие реакции, в результате которых вещества меняются своими составными частями. Например: 2NaOH + CuCl2 = 2NaCl + Cu(OH)2 Частный случай реакции обмена между кислотой и основанием носит также название реакции нейтрализации: NaOH + HCl = NaCl + H2O многие реакции органической химии, в которых вещества меняются своими составными частями относят к реакциям замещения. Подробнее — в таблице ниже посвященной классификации реакций в органической химии. |
|
обратимыетакие реакции обладают способностью протекать как в прямом, так и обратном направлении. Реакции, про которые обязательно нужно знать, что они обратимые: |
|
необратимыеТакие реакции протекают только в прямом направлении. Если речь идет о реакциях между электролитами, то необратимой реакция является в том случае, если образуется осадок, газ или малодиссоциирующее вещество. Например: Na2CO3 + 2HCl = 2NaCl + H2O + CO2 В качестве малодиссоциирующих веществ в реакциях ионного обмена могут образоваться вода, слабые кислоты, гидроксид аммония. |
|
экзотермическиеВ результате таких реакций выделяется энергия в виде теплоты. Обозначают такие реакции, добавляя «+Q» к уравнению реакции, например: |
|
эндотермическиеПри протекании таких реакций поглощается тепло. Для обозначения таких реакций пишут «-Q» в уравнении реакции. Практически все реакции разложения являются эндотермическими: Исключения: реакции разложения HI и NO являются экзотермическими. |
|
гомогенныеГомогенными реакциями называют такие реакции, реагенты в которых находятся в одной фазе. Примерами таких реакций могут быть многие реакции протекающие в растворах, реакции между газообразными веществами: NaOH (р-р) + HCl(р-р) = NaCl + H2O 2CO + O2 = 2CO2 В гомогенных реакциях не наблюдаются границы раздела между реагентами |
|
гетерогенныегетерогенными реакциями называют такие реакции, в которых реагирующие вещества находятся в разных фазах. Примерами таких реакций являются, взаимодействие цинка с раствором соляной кислоты, взаимодействие углекислого газа с известковой водой, и т.д.:
|
|
Химия — это просто
- Популярно о химии
-
· Что такое химия
· Периодическая таблица - ОБЩАЯ ХИМИЯ
- Вещества и смеси
- Атомы и молекулы
- Строение веществ
- Взаимодействие веществ
-
· Виды химических реакций
· Уравнения химических реакций
· Классификации химических реакций
· Баланс химических реакций
· Химическое равновесие
· Скорость химических реакций
· Окислительно-восстановительные реакции
· Составление уравнений ОВР
· Тепловой эффект реакции
· Закон Гесса
· Электрохимические элементы
· Кислоты и основания
· Сильные кислоты и основания
· Слабые кислоты и основания
· Кислотно-основные реакции
· Индикаторы
· Водородный показатель pH - НЕОРГАНИЧЕСКАЯ ХИМИЯ
- ОРГАНИЧЕСКАЯ ХИМИЯ
Скорость реакции
Некоторые химические реакции, например ржавение, протекают долго и медленно. Другие, такие, как взрыв пороха, проходят практически мгновенно.
элементы
При нагревании энергия частиц вещества увеличивается. Многие частицы приобретают энергию больше минимально необходимой для начала реакции. Только те молекулы твердого вещества, что находятся на поверхности, в состоянии вступать в реакции с другим веществом. Если раздробить твердое тело на мелкие части, площадь поверхности увеличится, и реакции пойдет быстрее. Химическую реакцию ускоряет и увеличение концентрации вещества. За последние 20 лет количество кислот в дождевой воде увеличилось, и дождь наносит теперь больше ущерба деревьям и каменным сооружениям.
Уравнения химических реакций
Вещества образуются во время химических процессов. Каждое соединение имеет химическую формулу. Чтобы описать происходящий процесс языком химии, используют уравнения реакций.
Используя постулаты атомно-молекулярного учения, можем сказать, что образование новых веществ является следствием перегруппировки атомов.
Возьмём медную проволоку и нагреем в пламени горелки. Медь металл красного цвета, после нагревания становится чёрной. Что с ней произошло?
Кислород О2 и медь Cu относятся к простым соединениям, образуют сложное соединение CuO.Чтобы описать данный процесс, используем символы в схеме реакции. Слева от стрелки реагенты, справа находятся продукты реакции.
Cu + O2 → CuO
Обратите внимание на рисунок и на схему. Согласно рисунку, чтобы произошла реакция, берут два атома Меди и одну молекулу кислорода О2
В следствии образуется две молекулы CuO оксида меди (II). Схема показывает, что до реакции 1 атом меди и молекула кислорода образуют сложное вещество CuO. Так как не появился новый вид атомов, а произошла только их перегруппировка, то их количество должно быть равно. Посмотрев на схему, можно увидеть, что количество отличается:
|
До реакции |
После реакции |
||
|
Cu |
1 |
= |
1 |
|
O |
2 |
> |
1 |
Чтобы схема стала уравнением, используем закон сохранения массы вещества (ЗСМВ), который был открыт Михаилом Васильевичем Ломоносовым. До его открытия, ЗСМВ носил разнообразные названия. Древние философы называли его «Законом сохранения атомов», а точнее «Принципом сохранения и неуничтожимости материи».
Используя ЗСМВ сделаем схему уравнением реакции, т.е. уравняем левую и правую части. Начнём с Кислорода. В правой части поставим 2 перед формулой (надеемся, Вы помните, что коэффициенты ставят перед формулой и никак не в средине)
Cu + O2 → 2CuO
Наверняка вы заметили, что изменилось количество атомов меди после реакции, чтобы было поровну, поставим 2 перед Cu.
2Cu + O2 → 2CuO
Следуя данному алгоритму, расставим коэффициенты в уравнении реакции
CH4 + O2 → CO2 + H2O
Начнём с Углерода, до реакции 1, после реакции 1. 1 = 1
Водород 4 > 2. Выбираем НОК (наименьшее общее кратное), это 4. Делим на индексы. До реакции 4/4 = 1. Значит перед СН4 должен быть коэффициент 1. После реакции 4/2 = 2. Перед Н2О ставим 2.
CH4 + O2 → CO2 + 2H2O
Кислород 2
Обратите внимание, Кислород входит в состав СО2 и Н2О, и перед водой стоит коэффициент 2. В сумме выходит 4
НОК равно 4. Выполнив аналогичные действия, как и с Водородом. Получаем коэффициент 2 перед О2.
CH4+ 2O2 → CO2 + 2H2O
Следует обратить внимание, что существуют так называемые «группы» атомов – кислотные остатки и гидроксо-группа –ОН. С ними Вы познакомитесь чуть позже, а сейчас рассмотрим принцип расстановки коэффициентов, используя эти группы

Классификация химических реакций
На рисунке видно, что классификация химических реакций составлена на основании конкретных признаков. Так, по числу вступивших в реакцию и образовавшихся веществ они бывают реакциями соединения, разложения, замещения и обмена. Реакции, в которых происходит изменение степеней окисления атомов элементов, называются окислительно-восстановительными. Реакции, протекающие без изменения степеней окисления, называются неокислительно-восстановительными.
В зависимости от того, идет ли реакция с выделением либо с поглощением энергии (тепла), существует деление на экзо- и эндотермические реакции.
В зависимости от участвующих компонентов, химические реакции могут иметь обратимый либо необратимый характер. Необратимые реакции протекают только в одном направлении, обратимые — в прямом и обратном направлении. При соответствующих условиях полученные вещества могут преобразоваться обратно, в первичные продукты. В отдельных случаях из двух растворенных веществ может синтезироваться нерастворимый продукт. Тогда реакция становится необратимой. Еще одним примером необратимого процесса является сгорание углеводородного топлива (в присутствии кислорода из атмосферы). В результате него выделяется тепловая и световая энергия, а также образуется углекислый газ и .
По наличию катализатора (вещества, которое изменяет скорость реакции, но при этом само не расходуется), реакции делятся на каталитические и некаталитические.
Рассмотрим более детально деление реакций по числу и составу веществ, вступающих во взаимодействие и получившихся в результате него:
По изменению степеней окисления реакции бывают: 1. С изменением степени окисления (происходит переход электронов от одного атома к другому):
2. Без изменения степени окисления. В этом случае каждый атом в конце реакции имеет ту же степень окисления, что и в начале:
Характеристика по тепловому эффекту:
Реакция с поглощением тепла (эндотермическая реакция):
В ходе данного взаимодействия поглощается 90,4 кДж тепла. -90,4 кДж — тепловой эффект реакции.
Реакция с выделением тепла (экзотермическая реакция):
В этой реакции выделяется 92,3 кДж тепла.
Следующим важным принципом классификации является критерий обратимости либо необратимости взаимодействия. Рассмотрим таблицу:
В уравнениях необратимых реакций используют стрелку →, для обратимых .
В химии существует ряд условий, при наличии которых реакция считается необратимой. Они отражены в таблице:
В случае обратимых реакций под воздействием внешних факторов (изменение концентрации веществ, температуры, давления) соотношение скоростей прямой и обратной реакций могут изменяться. Если скорость прямой реакции выше, чем обратной, в реакционной системе преобладают продукты реакции. В этом случае говорят, что равновесие смещено в сторону прямой реакции (вправо). Если скорость обратной реакции выше, и в системе преобладают исходные вещества, говорят, что равновесие смещено в сторону обратной реакции (влево). Факторы, влияющие на положение равновесия, перечислены в таблице.
Широко распространены реакции, которые с заметной скоростью протекают только в присутствии катализаторов — каталитические реакции. Большинство реакций, протекающих в живых организмах, происходят с участием ферментов (природных катализаторов). Используемая в гигиенических и санитарных мероприятиях перекись водорода (в концентрации 3%) является относительно устойчивым веществом. Однако при контакте с распадается на воду и кислород. В данном примере диоксид марганца является катализатором химической реакции разложения пероксида водорода.
Химическая реакция — что это такое
Когда говорят, что происходит химическая реакция, значит, что при взаимодействии двух веществ образуются другие, обладающие своими характерными свойствами. Эти свойства обуславливаются перегруппировкой атомов, в связи с чем разрушаются старые и формируются новые химические связи. Взаимодействие может происходить произвольно при контакте двух веществ, при нагревании (либо охлаждении), изменении давления, воздействии электрического тока, ионизации, радиационных процессов и т.п. Скорость реакций зависит от исходной концентрации реагентов, а также условий окружающей среды. Активация может происходить с помощью катализаторов либо физических факторов.
Согласно Закону сохранения материи (массы и энергии), в ходе химической реакции не происходит создание новой либо уничтожение существующей материи. Однако те компоненты, которые образовались, могут значительно отличаться по своим свойствам.
Для описания химических реакций используют химические уравнения , т.е. запись химической реакции с помощью определенных знаков и символов. Поскольку в ходе химических реакций атомы не исчезают и не возникают вновь, количество атомов одного элемента до и после реакции должно быть одинаковым. Для уравнивания числа атомов в уравнении используют специальные множители — коэффициенты, которые записывают перед формулами веществ.
Например, дана схема реакции (схемой называют запись химической реакции, в которой число атомов всех элементов до и после реакции не уравнено):
В формулах данного уравнения с левой стороны атомов кислорода больше, чем с правой (2 атома и 1 атом соответственно). Следовательно, его нужно сбалансировать с помощью коэффициентов. Правильный вид будет:
На практике определить, что прошла химическая реакция, можно по следующим признакам:
- изменение цвета;
- образование или исчезновение осадка;
- выделение газообразных продуктов реакции;
- выделение света;
- выделение или поглощение тепла.
Использование онлайн-расчёта

Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Классификация по тепловому эффекту



эндотермическая реакция
экзотермическая реакция
Все химические реакции протекают с выделением или поглощением теплоты
По тепловому эффекту все реакции делят на два вида:
Экзотермические реакции
Например, реакция горения этана:
2 С2Н6 + 7О2 ⇒ 4СО2 + 6Н2О + Q
К реакциям, идущим с выделением теплоты (экзотермическим), кроме реакций горения, относятся почти все реакции соединения (исключение реакция азота с кислородом с образованием оксида азота (II) — эндотермическая: N2 + O2 = 2NO –Q), реакции сопровождающиеся взрывом, разложения дихромата аммония, образования аммиака: N2 + 3H2 ⇒ 2NH3 , реакции нейтрализации, алюмотермия, синтез аммиака, и реакции в которых из менее стабильных веществ образуются более стабильные
Экзотермические реакции, в процессе протекания которых выделяется свет, называют реакциями горения. Например, реакция горения пропана:
С3Н8 + 5О2 ⇒ 3СО2 + 4Н2О + Q
Эндотермические
Например, реакция разложения малахита:
Cu2CO3 (OH)2 → CuO + CO2 + H2O — Q
Например: H2 + Cl2 = 2HCl + 184,6 кДЖ. В термохимических уравнениях вместо стрелки ставят знак равенства.
Типы реакций
Ниже представлены примеры химических реакций, проходящих в природе и проводимых в лаборатории:
1. Если поместить железный гвоздь в раствор сульфата меди, железо вытеснит медь из раствора и займет ее место, а медь выделится на поверхности гвоздя. Эта реакция — пример вытеснения активным элементом (железом) менее активного (меди).
2. Карстовые пещеры, сталактиты и сталагмиты образуются в результате реакции карбоната кальция, входящего в состав породы, и дождевой воды, содержащей растворенный диоксид углерода.

4. Когда мы перевариваем пищу, в нашем организме происходит множество разных реакций. В ходе их пища разлагается на более простые вещества, которые усваивает организм.
5. Глубоководные рыбы производят свет благодаря проходящим в их клетках реакциям, потому что на больших глубинах очень темно.
7. Известняк (карбонат кальция) при нагревании распадается на оксид кальция (известь) и углекислый газ. Это реакция термического разложения.
8. Горение, или сгорание, — это химическая реакции. Когда древесина горит, это означает, что она соединяется с кислородом воздуха. Продукты реакции — углекислый газ, вода и уголь или пепел.
9. Находящиеся в головке спички химикаты реагируют с красным фосфором, нанесенным на коробку, и это приводит к возгоранию.
10. Растения производят питательные вещества в ходе фотосинтеза. Это эндотермическая реакция, использующая энергию солнечного света.
11. Ржавение — форма коррозии. Коррозия — это химическая реакция металла с кислородом воздуха.
Заключение
Как и многие иные научные систематизации, приведенная в статье классификация реакций в определённом смысле условна. Химики договорились разложить химические превращения по классам на основе наиболее объективных признаков.
Но на деле всё сложнее. Многим реакциям соответствуют самые разные отличительные признаки.
Например, синтез аммиака (NH3) характеризуется признаками реакции окислительно- восстановительной, экзотермической, обратимой, соединения, гетерогенной, каталитической, идущей со снижением давления в реакционной среде.
Всё это надо учитывать в технологическом регламенте. Конкретный химический процесс всегда многогранен и качественно многообразен.
Смотри также:
- Тепловой эффект химической реакции. Термохимические уравнения
- Скорость химической реакции, ее зависимость от различных факторов
- Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
- Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
- Реакции ионного обмена
- Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
- Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
- Электролиз расплавов и растворов (солей, щелочей, кислот)
- Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии