Химическое равновесие. Общая характеристика
Под химическим равновесием можно понимать состояние химической системы, при котором исходное количество веществ в реакции не изменяется в течение времени.
Химическое равновесие можно разделить на три вида:
- истинное равновесие – это равновесие для которого характерно постоянство во времени при условии отсутствия внешнего воздействия. Если внешние условия изменяются, состояние системы тоже изменяется, однако после восстановления условий, состояние также становится прежним. Состояние истинного равновесия может рассматриваться с двух сторон: со стороны продуктов реакции и со стороны исходных веществ.
- метастабильное (кажущееся) равновесие – это состояние возникает, когда не выполняется какое-либо из условий истинного равновесия.
- заторможенное (ложное) равновесие – это такое состояние системы, которое необратимо меняется при изменении внешних условий.
Применение РИО
Во многих отраслях индустрии, сельском хозяйстве, в решении проблем экологии используются реакции ионного обмена. Несколько примеров применения РИО.
- Для обессоливания (деминерализации) воды с помощью катионитных и анионитных колонок. Катиониты поглощают ионы Ca2+, Mg2+, заменяя их на ионы H+. На анионите группа OH- заменяется анионами Cl-. В итоге получается почти дистиллированная вода.
- Для опреснения воды в космических кораблях и морских судах.
- Для обеспечения ионного обмена в почвах, что помогает улучшению их агротехнических свойств.
- Для извлечения ценных примесей (уран, золото, серебро).
- Для удаления ионов тяжелых металлов при очистке промышленных сточных вод.
В заключении интересный факт: домашние хозяйки, сами того не зная, используют правило Бертолле, когда применяют реакцию ионного обмена между столовым уксусом и пищевой содой. Выделяющийся при этом газ способствует «поднятию» теста.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакции ионного обмена протекали, необходимо, чтобы выполнялись не только условия: образование осадка, газа или воды, но и вещества –реагенты должны быть растворимыми.
Например:
- CuS + Fe(NO3)2 ≠ FeS + Cu(NO3)2
реакция не идет, потому что FeS – нерастворим, а так же нерастворимой солью является соль – реагент сульфид меди — (CuS).
- Na2CO3 + CaCl2 = CaCO3
реакция протекает, так как карбонат кальция нерастворим и соли – реагенты являются растворимыми.
↓+ 2NaCl
- Cu(OH)2 + Na2S – не протекает,
- Чтобы соль с основанием реагировали, необходима растворимость их обоих.
- Cu(OH)2 — нерастворим, хотя потенциальный продукт CuS был бы осадком. В одной системе 2-х осадков не бывает.
- 2NaOH + Cu(NO3)2 = Cu(OH)2 ↓+ 2NaNO3
- реакция протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
- Это требование не распространяется на растворимость исходных веществ дальше реакций соль1+ соль2 и соль + основание.
- Все растворимые кислоты реагируют со всеми карбонатами, в том числе нерастворимыми.
Вывод:
- Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
- Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть садок или гидроксид аммония.
Смотри также:
- Классификация химических реакций в неорганической и органической химии
- Тепловой эффект химической реакции. Термохимические уравнения
- Скорость химической реакции, ее зависимость от различных факторов
- Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
- Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
- Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
- Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
- Электролиз расплавов и растворов (солей, щелочей, кислот)
- Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Влияние изменения давления
Изменение давления оказывает влияние только на те системы, где хотя бы одно из веществ находится в газообразном состоянии. При увеличении давления уменьшается объем газов, а значит, увеличивается их концентрация.
Предположим, что давление в замкнутой системе повысили, например, в 2 раза. Это значит, что концентрации всех газообразных веществ (N2, H2, NH3) в рассматриваемой реакции возрастут в 2 раза. В этом случае числитель в выражении для Кравн увеличится в 4 раза, а знаменатель — в 16 раз, т. е. равновесие нарушится. Для его восстановления должна увеличиться концентрация аммиака и должны уменьшиться концентрации азота и водорода. Равновесие сместится вправо. Изменение давления практически не сказывается на объеме жидких и твердых тел, т. е. не изменяет их концентрацию. Следовательно, состояние химического равновесия реакций, в которых не участвуют газы, не зависит от давления.
Константа равновесия
Обозначим равновесные концентрации веществ , , , . Тогда так как = , k1 • α • β = k2 • γ • δ, откуда
где α, β, γ, δ — показатели степеней, равные коэффициентам в обратимой реакции; Кравн — константа химического равновесия.
Полученное выражение количественно описывает состояние равновесия и представляет собой математическое выражение закона действующих масс для равновесных систем.
При неизменной температуре константа равновесия — величина постоянная для данной обратимой реакции. Она показывает соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии.
Константы равновесия рассчитывают из опытных данных, определяя равновесные концентрации исходных веществ и продуктов реакции при определенной температуре.
Значение константы равновесия характеризует выход продуктов реакции, полноту ее протекания. Если получают К » 1, это означает, что при равновесии γ • δ » α • β, т. е. концентрации продуктов реакции преобладают над концентрациями исходных веществ, а выход продуктов реакции большой.
При Кравн « 1 соответственно выход продуктов реакции мал. Например, для реакции гидролиза этилового эфира уксусной кислоты
константа равновесия:
при 20 °C имеет значение 0,28 (то есть меньше 1).
Это означает, что значительная часть эфира не гидролизовалась.
В случае гетерогенных реакций в выражение константы равновесия входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции
Константы равновесия выражается так:
Значение константы равновесия зависит от природы реагирующих веществ и температуры.
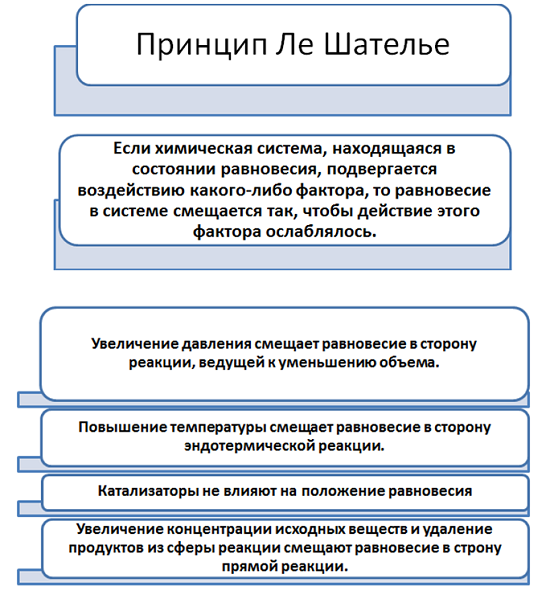
От присутствия катализатора константа не зависит, поскольку он изменяет энергию активации и прямой, и обратной реакции на одну и ту же величину. Катализатор может лишь ускорить наступление равновесия, не влияя на значение константы равновесия.
Состояние равновесия сохраняется сколь угодно долго при неизменных внешних условиях: температуре, концентрации исходных веществ, давлении (если в реакции участвуют или образуются газы).
Изменяя эти условия, можно перевести систему из одного равновесного состояния в другое, отвечающее новым условиям. Такой переход называют смещением или сдвигом равновесия.
Рассмотрим разные способы смещения равновесия на примере реакции взаимодействия азота и водорода с образованием аммиака:
Смещение химического равновесия, какие условия нужны
Применение обратимых реакций часто обусловлено технологическими причинами
При этом с экономической точки зрения важно добиться максимального выхода продукта реакции. Для достижения этой цели положение равновесия необходимо сместить в сторону образования продукта
Для этого используются известные приемы: меняют концентрацию веществ, прибегают к повышению либо понижению давления, нагревают либо, напротив, охлаждают рабочую среду. При этом важно помнить, что добавление катализаторов не приводит к смещению равновесия.
В списке приемов смещения равновесия в сторону продуктов реакции одно из первых мест занимает увеличение концентрации любого из реагентов (или обоих). В этом случае наблюдается смещение равновесия в правую сторону (образование продукта взаимодействия). Напротив, если концентрацию продуктов реакции уменьшать, смещение происходит в сторону их образования.
Например, задание: установить, как сместится равновесие в реакции соединения водорода и хлора. Схематически уравнение выглядит так:
Порядок смещения равновесия с помощью изменения давления можно наглядно продемонстрировать на примере реакции:
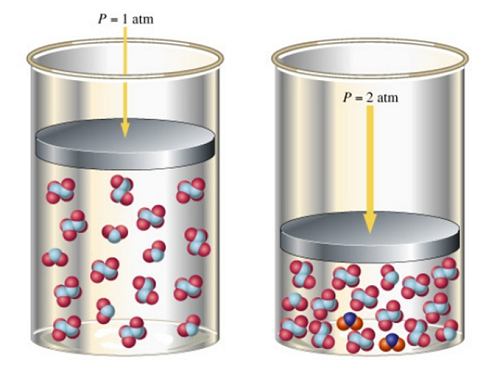
Влияние давления на положение равновесия зависит от числа молей газообразных веществ до и после реакции. При увеличении внешнего давления, равновесие смещается в сторону меньшего количества газообразных веществ. Слева в примере два моля азота реагируют с одним молем водорода. Справа один моль аммиака. Получается, что в правой части количество газообразных веществ меньше, чем в левой. Отсюда следует, что увеличение давления приведет к смещению равновесия вправо.
Влияние повышения температуры имеет следующий механизм действия: увеличение температуры приводит к повышению скорости как прямой, так и обратной реакции, но скорость эндотермической реакции возрастает в большее количество раз, чем скорость экзотермической. Поэтому повышение температуры смещает равновесие в сторону эндотермической реакции, понижение — в сторону экзотермической.
Если прямая реакция является экзотермической, то обратная — эндотермической.
Повышение температуры заставляет карбонат кальция разлагаться на оксид кальция и . При проведении реакции в закрытом сосуде создаются условия для того, чтобы данная реакция была обратима. При повышении температуры равновесие смещается в сторону эндотермической реакции (вправо). Напротив, уменьшая температуру, можно сместить равновесие в сторону экзотермической реакции (влево).
Те изменения, которые наблюдаются в равновесной системе при воздействии на нее внешнего воздействия, отражает принцип Ле Шателье.
Обобщение изложенного материала представлено в таблице:
Влияние изменения температуры
При повышении температуры скорости всех реакций (экзо- и эндотермических) увеличиваются. Причем повышение температуры больше сказывается на скорости тех реакций, которые имеют большую энергию активации, а значит, эндотермических.
Таким образом, скорость обратной реакции (эндотермической) увеличивается сильнее, чем скорость прямой. Равновесие сместится в сторону процесса, сопровождающегося поглощением энергии.
Направление смещения равновесия можно предсказать, пользуясь принципом Ле Шателье:
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, давление, температура), то равновесие смещается в ту сторону, которая ослабляет данное воздействие.
Таким образом:
• при увеличении концентрации реагирующих веществ химическое равновесие системы смещается в сторону образования продуктов реакции;
• при увеличении концентрации продуктов реакции химическое равновесие системы смещается в сторону образования исходных веществ;
• при увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше;
• при повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции;
• при понижении температуры — в сторону экзотермического процесса.
Принцип Ле Шателье применим не только к химическим реакциям, но и ко многим другим процессам: к испарению, конденсации, плавлению, кристаллизации и др. При производстве важнейших химических продуктов принцип Ле Шателье и расчеты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химических процессов, которые обеспечивают максимальный выход желаемого вещества.
Обратимые и необратимые химические реакции
Обратимые реакции – это процессы, которые протекают одинаково в обоих направлениях. Например:
- А+В=С+D (прямая),
- С+D=A+B (обратная).
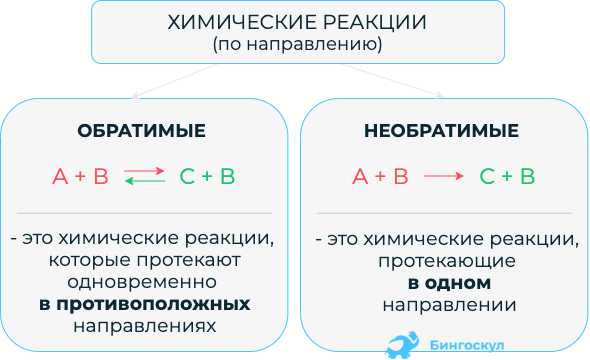

Реакции протекают при одинаковых условиях, образуют продукты равных объемах.
Необратимые реакции характеризуются процессом, который протекает в одном направлении, практически до конца. В продуктах всегда образуется нерастворимое соединение или газ, либо слабый электролит. Например: С+О2=СО2. Поскольку углекислый газ является летучим веществом, то разложить его на кислород и углерод невозможно.
Важно! Горение и взрывы в химии являются необратимыми процессами
Химическое равновесие
Химическое равновесие – это состояние химических веществ, при котором устанавливается одинаковая скорость протекания процессов прямой и обратной стороны. Смещать равновесие можно воздействием температуры, давления или увеличением концентрации одного из веществ.
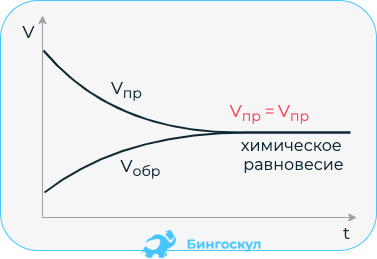
Равновесными называются реакции, в которых скорость прямой реакции равна скорости обратной реакции. То есть, образование продуктов происходит со скоростью расходования реагентов. Состояние равновесия характерно для любой обратимой реакции.
Равновесные реакции имеют одинаковые концентрации веществ. Рассмотрим подробный пример:
А+В=С+D – обратимая реакция. При взаимодействии веществ правой стороны их концентрация снижается, что снижает и скорость. Соответственно концентрация веществ левой стороны увеличивается. Постепенно эти показатели выравниваются и становятся равновесными. Это и называется равновесием.
Константа равновесия
Исходя из равновесия химических реакций, находят, что концентрации действующих веществ и полученных веществ остаются равными. Это называется равновесными концентрациями.
Константа равновесия является химическим выражением, описывающим закон действующих масс для равновесных систем. Для каждого реагента и продукта реакции обозначают равновесную концентрацию: , , , . Каждое значение возводят в степень равную коэффициенту, находящемуся перед веществом.
K равн= x×y/a×b
От наличия в реакции катализатора значение остается неизменным. Он способен ускорить уравновешивание скорости и концентраций.
Катализатор – вещество, которое ускоряет ход как прямой, так и обратной реакции и на смещение химического равновесия влияния не оказывает.
Важно! Для каждого химического процесса константа равновесия является постоянным неизменным значением.
Влияние на равновесную систему
С химическим равновесием разобрались, теперь двигаемся дальше.
Что будет, если на нашу идеальную равновесную систему оказать какое-либо влияние?
Произойдет смещение, то есть сдвиг равновесия – нарушение химического равновесия за счет преобладания скорости прямой или обратной реакции.
На химическое равновесие будет влиять несколько факторов:
- температура,
- давление и объем,
- концентрация реагента или продукта.
Как же определить, как именно какое-то воздействие повлияет на химическое равновесие? Здесь нам поможет волшебное правило Ле Шателье. Согласно ему при действии на систему, которая находится в равновесии, равновесие смещается в ту сторону, которая будет ослаблять воздействие.
То есть система, как капризный ребёнок, всё делает наоборот. Действие, которое будут оказывать на него, будет вызывать кучу криков и споров, то есть противодействие.
Теперь давайте углубимся в факторы, которые влияют на равновесие
Важно понимать, что может вывести систему из себя.
- Температура
Мы уже знаем, что по тепловому эффекту реакции делят на экзо- и эндотермические.
Подробнее об этом можно прочитать в следующей статье: «Электролитическая диссоциация электролитов в водных растворах».
Так как согласно правилу Ле Шателье система нам всегда противодействует, то:
- при повышении температуры (+) равновесие будет смещаться в сторону эндотермической реакции (-);
- при понижении температуры (-) – в сторону экзотермической реакции (+).
Подробнее про типы химических реакций можно прочитать в статье «Химические реакции по тепловому эффекту».
Рассмотрим теперь это на примере:
При увеличении температуры, равновесие такой реакции будет смещаться в сторону обратной реакции, так как именно в ту сторону будет идти эндотермическая реакция.
А при уменьшении температуры, равновесие сместится в сторону прямой реакции, так как там происходит экзотермическая реакция.
- Концентрация
Опять же вспоминаем, что система – вредный ребенок, который всё делает наоборот. Поэтому при добавлении какого-либо вещества (повышении концентрации) она старается поскорее его израсходовать, а при уменьшении концентрации (разбавлении) наоборот – экономить и забирать это вещество себе.
То есть при повышении концентрации реагентов и понижении концентрации продуктов происходит сдвиг равновесия в сторону продуктов, а при понижении концентрации реагентов и повышении концентрации продуктов равновесием смещается в сторону реагентов.
Рассмотрим теперь это на примере:
Что произойдет при увеличении концентрации азотистой кислоты?
Увеличится концентрация продукта, следовательно равновесие сместится в сторону реагентов.
Важно! Добавление твердых нерастворимых веществ не оказывает влияния на смещение равновесия. Однако при добавлении твердых растворимых веществ смещение может происходить, так как в воде растворимые вещества диссоциируют на ионы, то есть распадаются на заряженные частицы
Однако при добавлении твердых растворимых веществ смещение может происходить, так как в воде растворимые вещества диссоциируют на ионы, то есть распадаются на заряженные частицы.
Например:
- Давление (только для газов)
Правило “сделай наоборот” работает и для этого фактора. При увеличении давления равновесие смещается в сторону меньших объемов газов, а при уменьшении давления – в сторону больших объемов газов.
Как посчитать эти объемы газов?
Легко! Просто считаем сколько всего моль газов и в продуктах и в реагентах, где количество вещества больше, там и объем больше!
Рассмотрим на примере:
Что произойдёт при увеличении давления?
Считаем газы (в реагентах 2 моль, в продуктах 0 моль), поэтому равновесие сместится в сторону продуктов.
Важно! Давление и объем обратно пропорциональны, поэтому увеличение давления = уменьшение объема, а уменьшение давления = увеличение объема
| Может ли “такси” сместить химическое равновесие?Какое такси? Мы говорим о катализаторе, который разгоняет скорость химической реакции. Он и является “такси” в химии.Подробнее про это можно почитать в статье: «Скорость химической реакции».Так вот, несмотря на то, что катализатор влияет на скорость реакции, на смещение равновесия он влиять не будет! Так что его “услуги” тут не будут работать. |
Химическое равновесие

Чтобы описать состояние равновесия воспользуемся законом действующих масс.

Допустим, что скорости как прямой, так и обратимой реакции равны.
Вспомним канат, если силы равны, то возникает равновесие. Равновесие химических реакций можно выразить следующим образом, применив понятие константы равновесия, которая является мерой глубины прохождения реакции.
Однако равновесие в обратимых реакциях легко нарушить. Разберём с помощью каната, как его можно нарушить, т.е. сместить равновесие в ту или иную сторону.

Рассмотрим первый случай. Допустим, мы добавили в систему 2 моль водорода, как это повлияет на состояние равновесия.
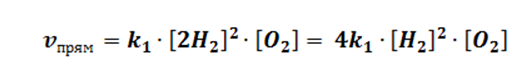
Путём математических вычислений, мы доказываем, что скорость прямой реакции взросла в 4 раза, значит, равновесие сместилось в сторону прямой реакции.
Проецируем данный пример на случай с канатом. Допустим, мы прибавили на одну из сторон 2 человека (в случае с задачей – моль), соответственно силы уже не равны, и побеждает та сторона, где участников процесса больше.

Влияние на химическое равновесие также оказывает температура. Как вам уже известно, реакции происходят либо с поглощением (эндотермические), либо выделением (экзотермические) тепла.
Химическая реакция соединения простых веществ водорода и кислорода, сопровождается выделением тепла. Если нагревать систему, то это приведёт к тому, что будет идти обратная реакция. Чтобы сместить равновесие вправо, необходимо наоборот охлаждать систему.
Логично предположить, чтобы сместить равновесие реакции с поглощением тепла, необходимо нагреть систему.
Давление также способствует нарушению равновесия, однако влияние идёт только на те соединения, которые находятся в газообразном состоянии.
Вспомним, что происходит с газами, если увеличить на них давление. Для этого представим воздушный шарик или мяч, который мы сильно сжимаем руками. Вследствие сжатия, его объём уменьшается, что приводит к увеличению содержания вещества.
В реакции образования воды реагирует три моль газов (2 моль Н2 и 1 моль О2) и образуется 2 моль газа (2Н2О). В данном случае, равновесие сместится в сторону получения Н2О.
Всё выше сказанное, относительно равновесия в химических системах, французский учёный ЛеШателье объединил в постулат.
Химия — это просто
- Популярно о химии
-
· Что такое химия
· Периодическая таблица - ОБЩАЯ ХИМИЯ
- Вещества и смеси
- Атомы и молекулы
- Строение веществ
- Взаимодействие веществ
-
· Виды химических реакций
· Уравнения химических реакций
· Классификации химических реакций
· Баланс химических реакций
· Химическое равновесие
· Скорость химических реакций
· Окислительно-восстановительные реакции
· Составление уравнений ОВР
· Тепловой эффект реакции
· Закон Гесса
· Электрохимические элементы
· Кислоты и основания
· Сильные кислоты и основания
· Слабые кислоты и основания
· Кислотно-основные реакции
· Индикаторы
· Водородный показатель pH - НЕОРГАНИЧЕСКАЯ ХИМИЯ
- ОРГАНИЧЕСКАЯ ХИМИЯ






























