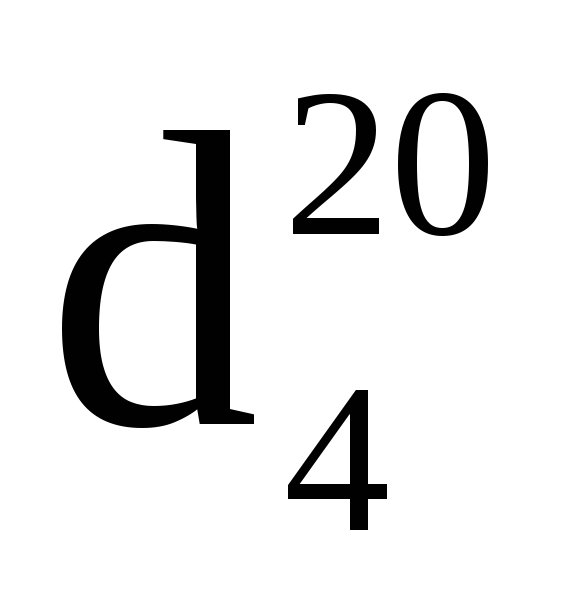Анализ простых эфиров
Химическое поведение алифатических и ароматических простых эфиров соответствует поведению родственных углеводородов. Простые эфиры отличаются от углеводородов по растворимости в холодной концентрированной сульфатной кислоте, что обусловлено способностью простых эфиров образовывать оксониевые соли.
Если простой эфир уже описали, то его можно идентифицировать по физическим свойствам или химически, расщеплением при нагревании с концентрированной иодистоводородной кислотой и последующим распознованием продуктов реакции.
Ароматические эфиры можно перевести в твердые продукты нитрования или бромирования и сравнить их температуры плавления с ранее описанными производными.
Расщепление простого эфира иодистоводородной кислотой используют для определения числа алкоксильных групп в алкилариловом эфире по методу Цейзеля.
Для распознавания простого эфира проводят спектральный анализ. В инфракрасном спектре простого эфира нет характерной $O-H$-полосы спиртов, но присутствует сильная полоса $C-O$ в области 1060-1300 см$^{-1}$: для алкиловых эфиров 1060-1150см$^{-1}$, для ариловых и виниловых эфиров 1200-1275 см$^{-1}$:
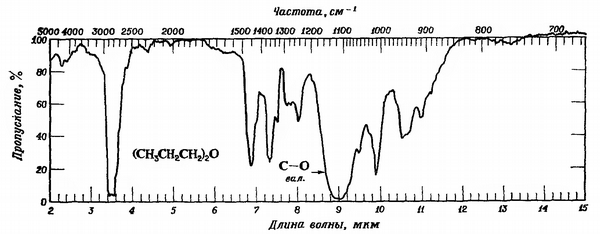 Рисунок 7.
Рисунок 7.
Номенклатура и изомерия.
Название сложных эфиров образуется из двух частей: сначала называется радикал, который заместил водород в карбоновой кислоте, а потом называется кислотный остаток кислоты. Поэтому когда перед глазами есть структурная формула сложного эфира, необходимо выделить радикал и фрагмент кислотного остатка, после чего назвать их. На рисунке ниже мы можем выделить остаток уксусной кислоты, имеющий название «ацетат», и радикал «этил». Соединив два слова, получим название сложного эфира – этилацетат.
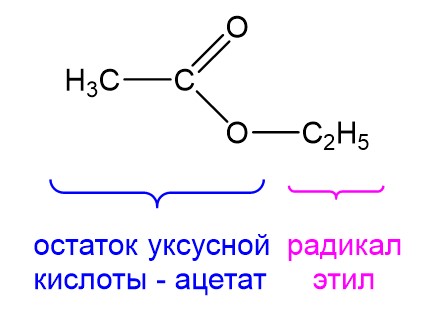
Можно также дать ему более длинное название: этиловый эфир уксусной кислоты. Учитывая, что уксусная кислота – это этановая кислота, то можно дать и еще одно название: этиловый эфир этановой кислоты. Наконец, поскольку соли этановой кислоты помимо ацетатов еще называют этаноатами, получаем четвертое название для нашего сложного эфира: этилэтаноат. Все четыре названия указывают на одно и то же вещество. В ЕГЭ часто специально используют разные названия.
Конечно, радикалы и кислотные остатки в сложных эфирах могут иметь более сложную структуру. Ниже показан такой пример:
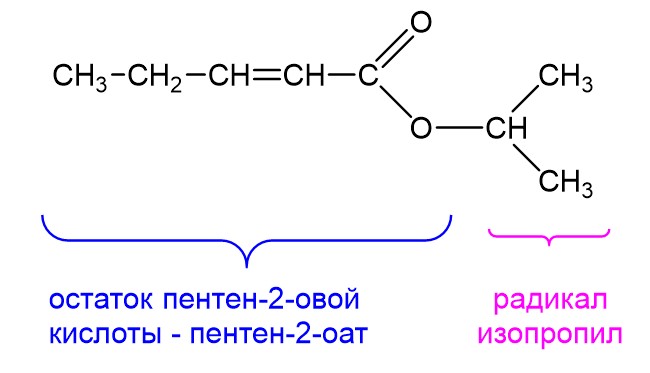
Кислотный остаток здесь образован пентен-2-овой кислотой и называется он пентен-2-оат. А радикал у нас изопропиловый. Соединяем названия радикала и кислотного остатка и получаем: изопропилпентен-2-оат. Такие сложные эфиры вряд ли встретятся в ЕГЭ, разве что в задании на отнесение веществ к классам органических соединений. Но главное понимать принцип того, как составлять их названия.
Понятно, что если радикалы R1 и R2 (см. самый первый рисунок) в сложном эфире достаточно длинные, то они могут давать изомерию углеродного скелета. То есть может метиловый эфир бутановой кислоты и метиловый эфир метилпропановой кислоты.
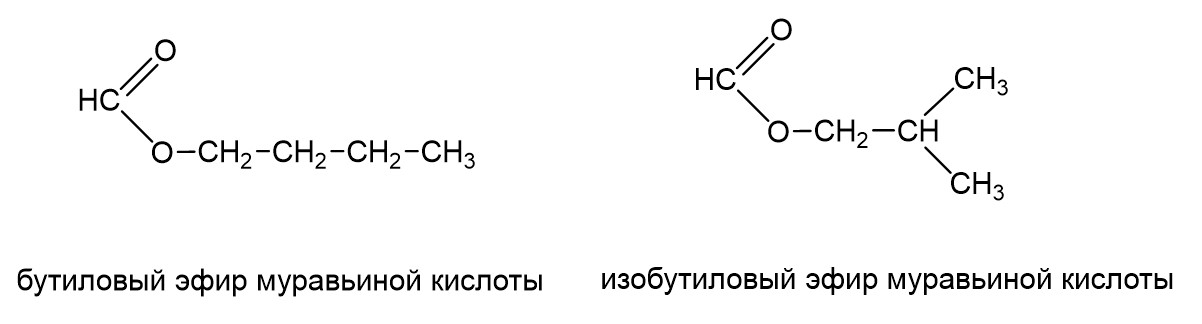
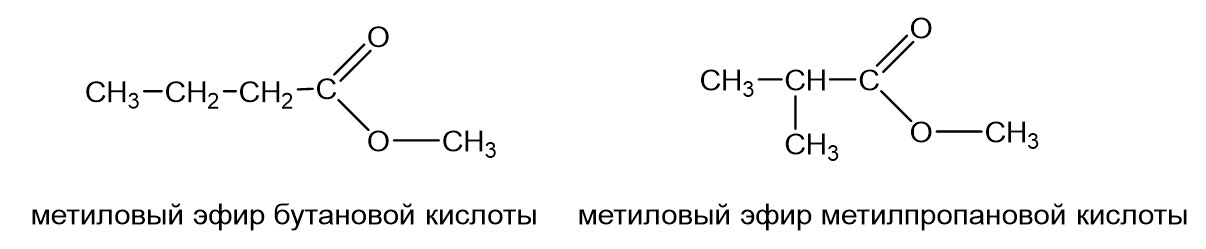 Это изомеры, кислотный остаток в одном случае имеет неразветвленный, а другом разветвленный углеродный скелет. То же самое с радикалом. Может быть бутиловый эфир муравьиной кислоты, а может быть изобутиловый эфир муравьиной кислоты.
Это изомеры, кислотный остаток в одном случае имеет неразветвленный, а другом разветвленный углеродный скелет. То же самое с радикалом. Может быть бутиловый эфир муравьиной кислоты, а может быть изобутиловый эфир муравьиной кислоты.
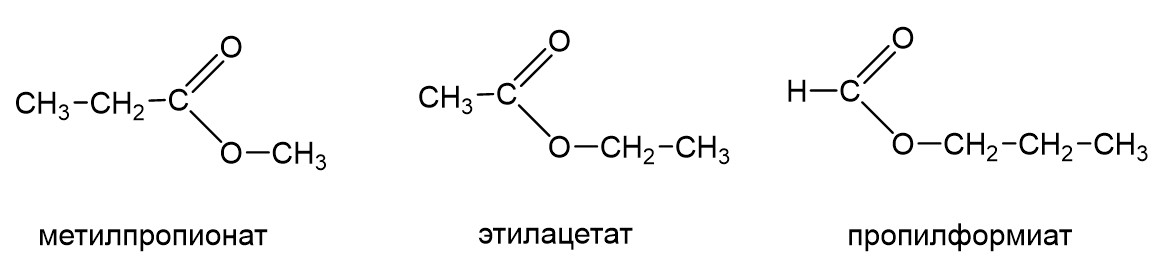
Также возможна изомерия положения сложноэфирной группы –СO–O–, то есть когда число атомов углерода в сложном эфире постоянно, а сложноэфирная группа смещается по углеродной цепи. Три таких изомера показаны ниже:
Наконец есть еще важный тип изомерии, знание которого часто проверяется в тестовой части ЕГЭ. Это межклассовая изомерия. У сложных эфиров есть межклассовые изомеры, а именно карбоновые кислоты. «Межклассовый» означает, что сложные эфиры и карбоновые кислоты относятся к разным классам органических соединений, но имеют одинаковую формулу гомологического ряда, а именно CnH2nO2. Ниже в качестве примера показаны этилацетат и бутановая кислота:
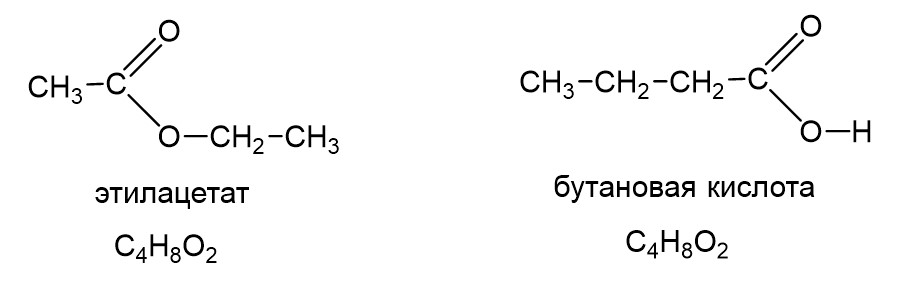
Для сложных эфиров, образованных из непредельной кислоты и/или содержащих непредельный радикал, возможна также изомерия положения кратной связи, а также цис-транс-изомерия.
Физические свойства и строение
Молекула эфира обладает суммарным дипольным моментом из-за полярности связей CO. Температура кипения других сравнима с алканами, но намного ниже, чем у спирта с сопоставимой молекулярной массой, несмотря на полярность связи C-O.
Физические свойства простых и сложных эфиров
Физические свойства простых эфиров
Диметиловый эфир и этилметиловый эфир являются газами при обычной температуре. Другие низшие гомологи представляют собой бесцветные, приятно пахнущие летучие жидкости с типичным запахом эфира.
Точки кипения
Связи C — O в эфире полярны, и, следовательно, эфиры имеют суммарный дипольный момент. Слабая полярность простых эфиров существенно не влияет на их температуры кипения, которые сопоставимы с температурами кипения алкенов с сопоставимой молекулярной массой. Эфиры имеют гораздо более низкие температуры кипения по сравнению с изомерными спиртами. Это происходит потому, что молекулы спиртов связаны водородными связями, в то время как молекулы эфира — нет.
Растворимость
Эфиры, содержащие до 3 атомов углерода, растворимы в воде благодаря образованию у них водородных связей с молекулами воды.
Растворимость уменьшается с увеличением числа атомов углерода. Относительное увеличение углеводородной части молекулы уменьшает тенденцию к образованию Н-связи. Эфиры хорошо растворимы в органических растворителях, таких как спирт, бензол, ацетон и т.д.
Физические свойства сложных эфиров
- Сложные эфиры представляют собой бесцветные жидкости с приятным запахом, в то время как сложные эфиры высших кислот представляют собой бесцветные твердые вещества.
- Низшие эфиры хорошо растворимы в воде. Растворимость сложных эфиров в воде быстро уменьшается с увеличением массы.
- Температуры кипения метиловых и этиловых эфиров ниже, чем у соответствующих исходных кислот.
Строение молекул
Структура молекул простых эфиров
Эфиры представляют собой класс органических соединений, которые содержат sp3-гибридизованный кислород между двумя алкильными группами и имеют формулу R-O-R’. эти соединения используются в красителях, парфюмерии, маслах, восках и других промышленных целях. Алифатические эфиры не имеют арильных групп, непосредственно присоединенных к эфирному кислороду.
Алифатические эфиры
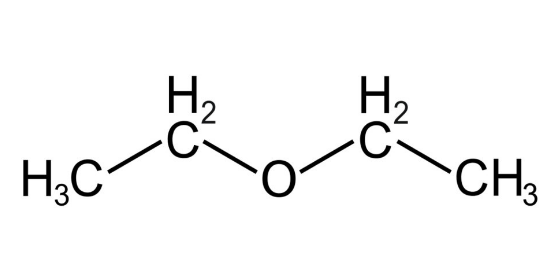
Примеры алифатических эфиров
Ароматические эфиры имеют по меньшей мере одно арильное кольцо, непосредственно присоединенное к эфирному кислороду. В ариловых эфирах одиночные пары, образующиеся на кислороде, сопряжены с ароматическим кольцом, что значительно изменяет свойства эфира.
Ариловые эфиры
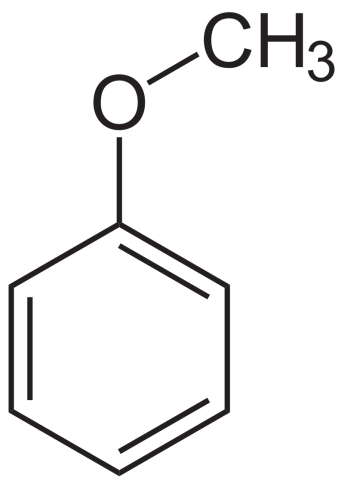
Пример ароматических эфиров
Гибридизация кислорода sp3 дает эфиры примерно той же геометрии, что и спирты и вода. Угол связи R-O-R’ близок к тому, что ожидается в тетраэдрической геометрии. Угол связи диметилового эфира составляет 112o, что больше, чем угол связи H-O-H в воде (104,5 o) из-за стерического отталкивания метильных групп.
Угол эфирной связи
Наличие электроотрицательного атома кислорода придает эфирам небольшой дипольный момент.
Спектральные свойства
Спектроскопия простых эфиров
Инфракрасная спектроскопия
Кислород образует две связи. Атом кислорода может быть найден между двумя атомами углерода, как в дибутиловом эфире.
Бутиловый эфир масляной кислоты + вода → (H+) → масляная кислота + бутанол-1
Если мы посмотрим на ИК-спектр дибутилового эфира, то увидим:
- существуют обычные режимы растяжения sp3 C-H и изгиба \(CH_2\) при 2900 и 1500 см-1;
- наблюдается сильный пик около 1000 см-1. Этот пик обусловлен вибрацией растяжения C-O.
Рисунок ИК. ИК-спектр дибутилового эфира
ЯМР-спектроскопия (ядерного магнитного резонанса)
- Атомы водорода на углероде, прилегающем к эфиру, обнаруживаются в районе 3,4-4,5 частей на миллион.
- Аналогичные пики в эпоксидах смещены в несколько более высокое поле, чем в других эфирах. Содержание водорода в углеродах и эпоксидах составляет от 2,5 до 3,5 промилле.
Спектр ЯМР 1Н дипропилового эфира показывает три сигнала с триплетом при 3,37 промилле, присвоенным -\(СН_2\)- рядом с эфиром, и двумя другими сигналами в верхнем поле (1,59 и 0,93 промилле). Протоны, расположенные ближе к электрону, отводящему атом кислорода, находятся дальше по полю, что указывает на некоторое ослабление защиты. Протоны в (A) и (C) каждый связаны с двумя эквивалентными (B) протонами. Итак, каждый из этих сигналов выглядит как триплет. Протоны (B), в свою очередь, соединены с набором из двух и трех эквивалентных протонов, и поэтому вы формально ожидаете четверку тройняшек. Однако, поскольку константы связи очень похожи, сигнал отображается в виде секстета.
Химическое поведение и свойства
Простые эфиры можно отнести к малореакционноспособной группе органических соединений, так как они проявляются слабоосновные свойства. Расщепляются только некоторые вещества и только при нагревании.
Окисление
Реакция окисления проходит с образованием перекисных соединений, что называется автоокислением. При хранении способны окислятся при помощи кислорода и образовывать перекиси, а именно неустойчивые гидропероксиды и пероксиды
При перегонке простых эфиров особенно важно тщательно отчистить их от перекисей, так как они потенциально способны вызвать взрыв
Разложение
Расщепляются при температуре до 120-150 градусов по Цельсию с концентрированными бромоводородом или ионоводородом 48% концентрацией.
Эфиры, которые содержат третичную алкильную группу, расщепляются легче.
Способны образовывать карбокатион, если есть третичная алкильная, бензильная или аллильная группа. Реакция происходит по Sn1-механизму в качестве интермедиата. Данные реакции протекают в мягких условиях, кислотным агентом может выступать трифторуксульная кислота.
Синтез
Синтез простых эфиров протекает по реакции Вильямсона. Суть реакции в том, что алкилгалогениды взаимодействуют с алкоголятами щелочных металлов.
Таким образом получаются симметричные и ассиметричные эфиры.
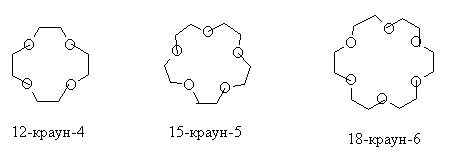
Реакция Вильямсона получила второе рождение после того, как открыли класс краун-эфиров. В них первая цифра означает размер цикла, вторая – число атомов кислорода, участвующих в цикле.
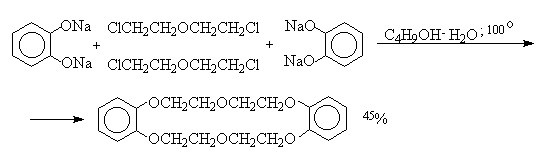
В 1967 году благодаря реакции Вильямсона был получен первый краун-полиэфир, который назывался дибензо-18-краун-6. Реакция происходила между хлорэтиловым эфиром и динатриевой солью пирокатехина.
Восстановление
Реакция восстановления протекает согласно уравнению:
Для результата требуются жесткие условия. Труднее всего реакция протекает с дифениловым эфиром или его производными.
Применение в медицине и фармации
Диэтиловый эфир применяют для изготовления настоев, экстрактов некоторых лекарственных форм для наружного применения, ограниченно — в хирургической практике для наркоза.
Его смесь с этанолом в пропорции 1: 3 под названием капель Гофмана используют при головокружении. Бутилвиниловый эфир является исходным продуктом синтеза поливинилбутилового эфира, который применяют при фурункулах, трофических язвах, ожогах, обморожениях (бальзам М.Ф. Шостаковского или винилин). К арилалкиловым эфирам можно отнести и димедрол, который применяют как антигистаминный препарат. Эфиры — растворители жиров, лаков и других органических соединений. Используются в производстве ароматических веществ, красителей.
Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
1. Этерификация
кислот спиртами.
Гидроксил кислоты
выделяется в составе воды, спирт же
отдает лишь атом водорода. Реакция
обратима, те же катионы катализируют и
обратную реакцию.
2.
Взаимодействие ангидридов кислот со
спиртами.
3. Взаимодействие
галогенангидридов со спиртами.
Некоторые физические
свойства сложных эфиров приведены в
табли-
це 12.
Таблица 12
Некоторые физические
свойства ряда сложных эфиров
|
Строение |
Название |
Плотность
|
|||
|
метилформиат |
|||||
|
этилформиат |
|||||
|
метилацетат |
|||||
|
этилацетат |
|||||
|
н-пропилацетат |
|||||
|
н-бутилацетат |
Сложные эфиры
низших карбоновых кислот и простейших
спиртов – жидкости с освежающим фруктовым
запахом. Употребляются как отдушки для
приготовления напитков. Многие эфиры
(уксусноэтиловый, уксуснобутиловый)
широко применяются как растворители,
особенно лаков.
Сложные эфиры
– жидкости, обладающие приятными фруктовыми запахами. В воде они растворяются очень мало, но хорошо растворимы в спиртах. Сложные эфиры очень распространены в природе. Их наличием обусловлены приятные запахи цветов и фруктов. Они даже могут находиться в коре некоторых деревьев.
Посмотрите на экран и рассмотрите состав сложных эфиров, которые придают запах цветам. Демонстрируются слайды: запах жасмина — бензилпропаноат, хризантемы – сложный эфир фенилэтилового спирта и муравьиной кислоты. Как мы видим сложные эфиры, которые имеют цветочные запахи, это чаще всего производные ароматических кислот или ароматических спиртов. А вот сложные эфиры, которые входят в состав известных вам фруктов имеют довольно простой состав.
Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Воски не растворяются в воде. Их можно формовать в нагретом состоянии. Примерами животных восков могут служить пчелиный воск, а также ворвань (спермацет), содержащийся в черепной коробке кашалота (кашалотовый воск). Пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат): CH 3 (CH 2) 14 –CO–O–(CH 2) 29 CH 3 .
Обратный процесс
– расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат — анион RCOO – не вступает в реакцию с нуклеофильным реагентом – спиртом).
Эта реакция называется омылением
сложного эфира.
Применение
сложных эфиров очень разнообразно (Сообщение).
Их применяют в промышленности в качестве растворителей и промежуточных продуктов при синтезе различных органических соединений. Сложные эфиры с приятным запахом используют в парфюмерии и пищевой промышленности. Сложные эфиры часто служат исходными веществами в производстве многих фармацевтических препаратов.
Жиры как сложные эфиры. Классификация жиров.
Важнейшими представителями сложных эфиров являются жиры.
При нагревании жиров с водой в щелочной среде французский ученый Э. Шеврель установил, что жиры расщепляются и образуются глицерин и различные карбоновые кислоты. Французский ученый М.Бертло в 1854 г. осуществил обратный процесс: при нагревании глицерина с высшими карбоновыми кислотами он получил жиры и воду.
При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры: R 1 -COOH (кислота) + R 2 -OH (спирт) R 1 -COOR 2 (сложный эфир) + H 2 OЭта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ — спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции этерификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификации) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих веществ.
Применение некоторых простых эфиров
При комнатной температуре эфиры представляют собой бесцветные жидкости с приятным запахом. По сравнению со спиртами эфиры, как правило, менее плотны, менее растворимы в воде и имеют более низкие температуры кипения. Они относительно неактивны, и в результате они полезны в качестве растворителей для жиров, масел, восков, отдушек, смол, красителей, смол и углеводородов. Пары некоторых эфиров используются в качестве инсектицидов, митицидов и фумигантов для почвы.
Эфиры также важны в медицине и фармакологии, особенно для использования в качестве анестетиков. Например, этиловый эфир (\(CH_3CH_2―O―CH_2CH_3\)), известный просто как эфир, впервые был использован в качестве хирургического анестетика в 1842 году. Кодеин, мощный обезболивающий препарат, представляет собой метиловый эфир морфина. Поскольку эфир легко воспламеняется, он в значительной степени был заменен менее легковоспламеняющимися анестетиками, включая закись азота (\(N_2O\)) и галотан (\(CF_3-CHClBr\)).
Этиловый эфир является отличным растворителем для экстракции и для широкого спектра химических реакций. Он также используется в качестве летучей пусковой жидкости для дизельных двигателей и бензиновых двигателей в холодную погоду. Диметиловый эфир используется в качестве распыляемого топлива и хладагента. Метил-т-бутиловый эфир (МТБЭ) — это присадка к бензину, которая повышает октановое число и уменьшает количество загрязняющих веществ, содержащих оксид азота, в выхлопных газах. Эфиры этиленгликоля используются в качестве растворителей и пластификаторов.
СЛОЖНЫЕ ЭФИРЫ.
Сложные эфиры — это производные карбоновых кислот, в которых гидроксильная группа замещена на остаток спирта.
Номенклатура.
По систематической номенклатуре названия сложных эфиров производят от названия углеводородного радикала и кислотного остатка, с которым связан радикал. При названии кислотного остатка вместо окончания «-овая» и слова «кислота» используют суффикс «-ат».
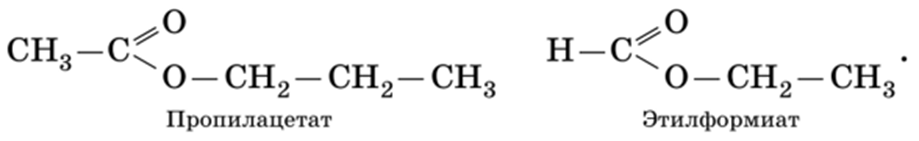
Часто сложные эфиры называют по остаткам кислот и спиртов, из которых они состоят. Эфиры, рассмотренные выше, могут быть названы уксуснопропиловым и муравьино-этиловый соответственно.
Изомерия.
Для сложных эфиров характерны:
1) изомерия углеродного скелета:
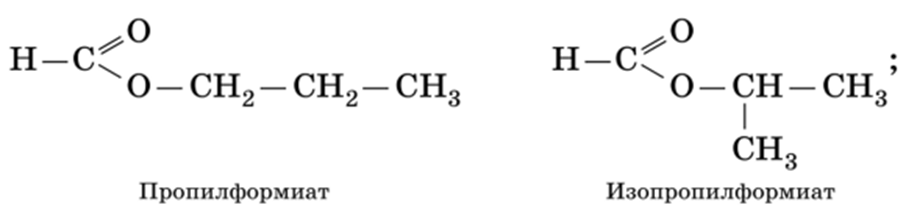
2) изомерия положения сложноэфирной группы (начинается со сложных эфиров, в молекуле которых содержится не менее 4-х атомов углерода):
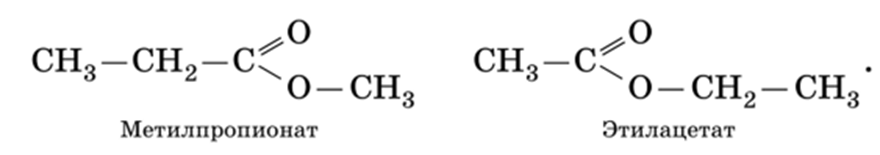
3) межклассовая изомерия:
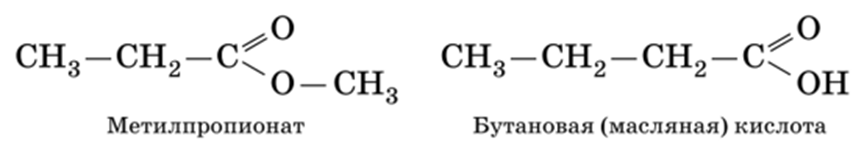
Физические свойства и применение.
Сложные эфиры низших карбоновых кислот и спиртов — летучие, легковоспла-меняющиеся жидкости с плотностью меньше 1,0. Они практически нерастворимы в воде, зато хорошо растворяются в неполярных органических растворителях. Сложные эфиры не участ-вуют в образовании межмолекулярных водородных связей, поэтому температуры их кипения ниже, чем у карбоновых кислот со сходной молекулярной массой. Многие низкомолекулярные эфиры обладают приятным фруктовым запахом, например масляноэти-ловый эфир — запахом абрикосов, маслянобутиловый — ананасов, уксусноизоамиловый — груши и т. д. Их применяют в качестве отдушек при приготовлении напитков. Многие сложные эфиры — прекрасные растворители, поэтому они используются в химичес-ком синтезе и технике.
Сложные эфиры высших жирных кислот и высших одноатомных спиртов называют восками. Это твёрдые вещества, обладающие слабым запахом, с низкими температурами кипения, нерастворимые в воде.
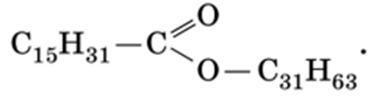
Например, основным веществом пчелиного воска является сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
Способы получения.
Сложные эфиры получают реакцией этерификации — взаимодействием карбоновой кислоты со спиртом в присутствии сильной минеральной кислоты при нагревании:
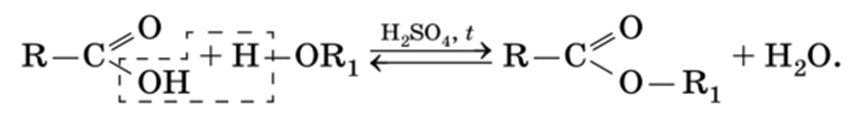
Этерификация — обратимый процесс. Прямая реакция — это образование сложного эфира, обратная — его кислотный гидролиз. Для смещения равновесия в сторону образования конечного продукта реакции необходимо отгонять воду.
Сложные эфиры можно получить из хлорангидридов прямым взаимодействием со спиртами:
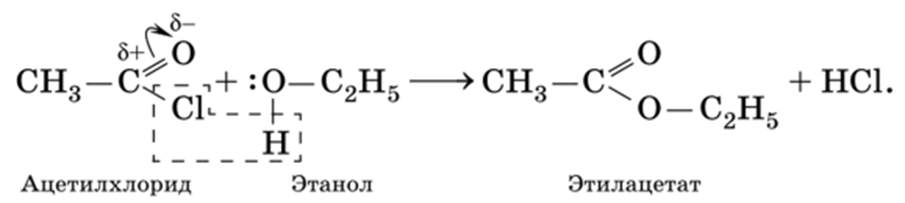

Для усвоения изученного материала посмотрите видео-урок, используя данную ссылку: https://dzen.ru/video/watch/623c0fd3857243113c900977?share_to=link
Химические свойства.
Сложные эфиры характеризуются низкой реакционной способностью. Они вступают в химические реакции только при нагревании и в присутствии катализатора. Особого внимания заслуживает гидролиз сложных эфиров. Эти соединения подвергаются гидролизу при нагревании в присутствии минеральных кислот или щелочей. В кислой среде реакция обратима и представляет собой реакцию обратную реакции этерификации6
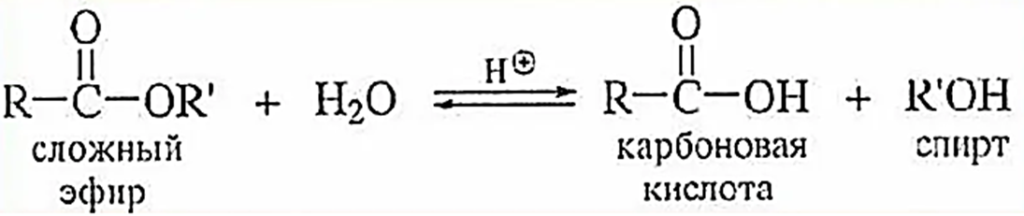
При нагревании со щелочью сложные эфиры необратимо гидролизуются с образованием соли исходной карбоновой кислоты и спирта:
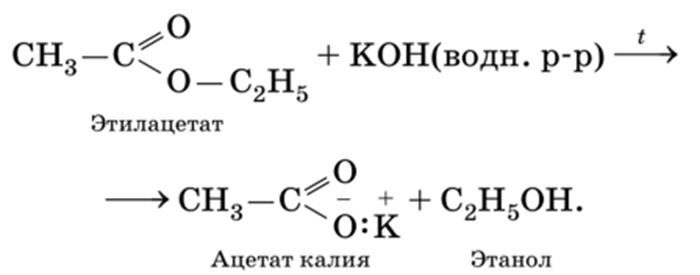
Для сложных эфиров характерна реакция гидрирования (восстановления), т.е. реакция присоединения водорода:
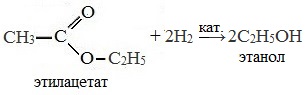
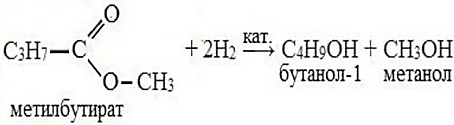
Под действием аммиака (аммонолиз)при нагревании сложные эфиры превращаются в амиды соответствующих карбоновых кислот:
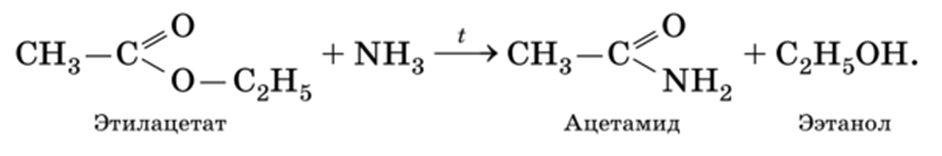
Реакция горения характерна для сложных эфиров, точно также как и для всех органических соединений:
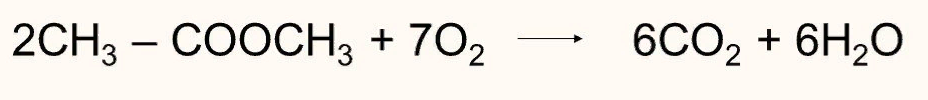
Среди сложных эфиров особое место занимают жиры.
Для усвоения изученного материала посмотрите видео-урок, используя данную ссылку: https://www.youtube.com/watch?v=G7yBEGufpnE
Сложные эфиры
Гидролиз сложных эфиров:
В кислой среде эстер гидролизует, образуя соответствующую кислоту и спирт.
СН3—СОО—С2Н5 = СН3—СООН + Н2О
Омыление сложных эфиров:
При повышенной температуре эстеры реагируют с водными растворами сильных оснований, таких как гидроксид натрия или калия, образуя соли карбоновых кислот. Соли жрных карбоновых кислот называют мылами. Побочным продуктом реакции омыления является спирт.
СН3—СОО—С2Н5 + NaОН = СН3—СООNa + С2Н5—ОН
Реакции переэстерефикации (обмена):
Сложные эфиры вступают в реакции обмена при действии спирта (алкоголиз), кислоты (ацидолиз), или при двойном обмене, при взаимодействии двух сложных эфиров.
СН3—СОО—С2Н5 + С3Н7—ОН = СН3—СОО—С3Н7 + С2Н5—ОН
СН3—СОО—С2Н5 + С3Н7—СООН = С3Н7—СОО—С2Н5 + СН3—СООН
СН3—СОО—С2Н5 + С3Н7—СОО—СН3 = СН3—СОО—СН3 + С3Н7—СОО—С2Н5
Реакции взаимодействия с аммиаком:
Сложные эфиры могут взаимодействовать с аммиаком (NН3) с образованием амида и спирта. По тому же принципу реагируют они и с аминами.
СН3—СОО—С2Н5 + NН3 = СН3—СО—NН2 + С2Н5—ОН
Реакции восстановления эстеров:
Эфиры могут быть восстановлены водородом (Н2) в присутствии хромита меди (Cu(CrO2)2).
СН3—СОО—С2Н5 + 2Н2 = СН3—СН2—ОН + С2Н5—ОН
Физические свойства и строение
Физические свойства
Эфиры — бесцветные, подвижные, легкокипящие жидкости с характерным запахом. Эфиры малорастворимы в воде, но хорошо растворяются в органических растворителях и сами растворяют органические соединения.
Строение молекул
Строение молекул простых эфиров схоже со строением молекулы воды. Валентный угол С–O–C в диметиловом эфире составляет 112°. Атом кислорода имеет sp3-гибридизацию.
Спектральные свойства
Характеристической полосой простых эфиров в инфракрасном спектре является полоса при 1150–1080 см–1, соответствующая колебаниям группы C–O–C.
В спектрах 1Н ЯМР группа CH3O алкиловых эфиров имеет сигнал при 3,3-4,0 м. д., а та же группа метилариловых эфиров — при 3,7 м. д. Сигналы протонов двойной связи в виниловых эфирах (вида СН=СН–О) находятся при 5,7-7,5 м. д. (α-положение) и 3,5-5,0 м. д. (β-положение). Если сравнивать эти значения с положением сигналов в аналогичной углеводородной системе СН=СН–С, то сигнал α-углеродного атома оказывается смещённым на +1,2 м. д., а сигнал β-углеродного атома — на –1 м. д.
В спектрах 13C ЯМР насыщенных простых эфиров атом углерода, находящийся в α-положении от атома кислорода, даёт сигнал в области 50-100 м. д., а более удалённые атомы углерода — в области 10-60 м. д. У виниловых эфиров углероды двойной связи (С=С–О) дают сигналы при 115-165 м. д. (α-положение) и 70-120 м. д. (β-положение). При этом, если сравнивать спектры с углеводородными системами типа С=С–С, то сигнал α-углеродного атома в виниловых эфирах оказывается смещённым на +15 м. д., а сигнал β-углеродного атома — на –30 м. д. У ароматических простых эфиров сигнал α-углеродного атома кольца наблюдается при 135-155 м. д. (смещение +25 м. д. по сравнению с ареном). Сигналы остальных ароматических атомов углерода при введении эфирной группы смещаются на –15 м. д. (орто-положение), +1 м. д. (мета-положение) и –8 м. д. (пара-положение).
В масс-спектрах алифатических простых эфиров молекулярный ион проявляется в виде слабого сигнала, для ароматических простых эфиров — в виде интенсивного сигнала. Основное направление фрагментации молекулярного иона — разрыв связи между α- и β-углеродными атомами и гетеролитический разрыв связи C–O. В результате возникают ионы с массой (m/z), равной 31, 45, 59… М–46, М–33, М–18.
Для алкилариловых простых эфиров фрагментация протекает через потерю алкильной цепи. У диариловых эфиров молекулярный ион или ион М–Н теряет группу CO, а также происходит разрыв связи между атомом кислорода и арильным заместителем. Также в ходе масс-спектрометрии простые эфиры претерпевают перегруппировки с отщеплением молекулы спирта либо — в случае ариловых простых эфиров — с отщеплением алкена и образованием фенола.
В промышленности таким способом получают простые эфиры из изобутилена либо изоамилена и метанола либо этанола, нагревая их над катионитом в кислой форме. При этом получают трет-бутилметиловый, трет-бутилэтиловый, трет-амилметиловый и трет-амилэтиловый эфиры.
В лабораторных условиях большее значение имеет реакция алкоксимеркурирования алкенов. Она аналогична реакции оксимеркурирования, при помощи которой алкены селективно превращают в спирты, однако в данном случае роль нуклеофильного реагента выполняет не вода, а спирт, который берут в качестве растворителя. Сам алкен вводят в реакцию с ацетатом ртути либо — для получения эфиров со вторичной или третичной алкильной группой — трифторацетатом ртути, а затем полученный продукт демеркурируют при помощи боргидрида натрия. Формально эта реакция представляет собой присоединения спирта по двойной связи согласно правилу Марковникова.
Реакция Вильямсона
Симметричные и несимметричные простые эфиры можно получить по реакции Вильямсона между алкоголятами и галогеналканами (либо сульфонатами). Эта реакция представляет собой нуклеофильное замещение по механизму SN2, и для неё верны соответствующие закономерности. Например, если в конечном продукте содержится вторичный или третичный заместитель, его следует вводить при помощи алкоголята, а не галогенида, поскольку в ином случае вместо замещения будет происходить реакция элиминирования. Наилучшими галогенидами в этой реакции являются первичные галогениды, а также аллил- и бензилгалогениды.
Некоторые примеры использования конкретных представителей эфиров

Простые эфиры применяются во многих областях человеческой деятельности. Например, в качестве добавки к моторному маслу (диизопропиловый эфир), теплоносителя (дифенилоксид). Кроме того, данные соединения используются как промежуточные продукты для получения лекарств, красителей, ароматических добавок (метилфениловый и этилфениловый эфиры).
Интересным эфиром является диоксан, отличающийся хорошей растворимостью и в воде, и позволяющий смешивать данную жидкость с маслами. Особенность его получения заключается в том, что две молекулы этиленгликоля соединяются друг с другом по гидроксильным группам. В результате образуется шестичленный гетероцикл с двумя атомами кислорода. Он образуется под действием концентрированной серной кислоты при 140 о С.
Таким образом, простые эфиры, как и все классы органической химии, отличаются большим разнообразием. Их особенностью является химическая инертность. Связано это с тем, что, в отличие от спиртов, они не имеют атома водорода у кислорода, поэтому он не является столь активным. По этой же причине простые эфиры не образуют водородные связи. Именно вследствие таких свойств они способны смешиваться с различного рода гидрофобными компонентами.
В заключение хотелось бы отметить, что диэтиловый эфир применяется в экспериментах по генетике для усыпления мух дрозофил. Это лишь малая часть того, где используются данные соединения. Вполне возможно, что на основе простых эфиров в будущем изготовят ряд новых прочных полимеров с улучшенной структурой по сравнению с существующими.
Общие сведения
Эфиры (от греческого слова Aethеr — эфир, небо, воздух) (простые эфиры) — это производные спиртов, энола и фенолов (общая формула R-O-R ‘).
Если радикалы одинаковы, то эфиры — симметричные, если разные — несимметричные или смешанные. В зависимости от природы радикалов различают диалкил, диарилови, дициклоалкилови, арилалкил, алкилвинилови и др. К эфиры относятся также Глим, карбитолы, целлозоли и некоторые гетероциклические соединения (1,4-диоксан, оксиран, оксолан, тетрагидрофуран и т.п.).
Названия эфиров образуют от названий углеводородных радикалов путем добавления суффикса -ный и слова «эфир», например, СН3-О-СН3 — диметиловый эфир, СН3-О-С2Н5 — метилетиловий эфир.
Эфиры рассматривают как алкокси-, циклоалкокси-, арилоксипроизводные углеводородов, в этом случае сложнее радикал считается родоначальной структурой: CH3-О-СН 2 СН 3 — метоксиетан, С2Н5О-С3Н7 — этоксипропан, С6Н5-ОСН3 — метоксибензол.
Некоторые эфиры имеют тривиальные названия: С6Н5-ОСН3 — анизол, С6Н5-С2Н5 — фенетол, 2-СН3ОС6Н4ОН — гваякол.
Диметиловый и метилэтиловый эфиры при обычных условиях являются газами. Все остальные эфиры — это бесцветные жидкости или кристаллические вещества с приятным или характерным «эфирным» запахом, плохорастворимые в воде, хорошо — в органических растворителях (таблица).
Эфиры с двойными связями и циклические представители

Как в других группах органических соединений, среди простых эфиров обнаруживаются соединения с двойными связями. Среди способов получения данных веществ есть особые, не характерные для насыщенных структур. Заключаются они в использовании алкинов, по тройной связи которых происходит присоединение кислорода и образование виниловых эфиров.
Учеными описано получение простых эфиров циклической структуры (оксиранов) с использованием способа окисления алкенов надкислотами, содержащими вместо гидроксильной группы перекисный остаток. Данная реакция также проводится под действием кислорода в присутствии серебряного катализатора.

Применение простых эфиров в лабораториях заключается в активном использовании данных соединений в качестве химических растворителей. Популярным в этом плане является диэтиловый эфир. Как и все соединения данной группы, он инертен, не реагирует с растворяемыми в нем веществами. Температура его кипения составляет чуть более 35 о С, что удобно при необходимости быстрого упаривания.
В простых эфирах легко растворяются такие соединения, как смолы, лаки, красители, жиры. Производные фенола применяются в косметической промышленности в качестве консервантов и антиоксиданстов. Кроме того, эфиры добавляются в моющие средства. Среди данных соединений обнаружены представители, обладающие выраженным инсектицидным действием.
Циклические эфиры сложной структуры применяются при получении полимеров (гликолида, лактида, в частности), используемых в медицине. Они выполняют функцию биосорбируемого материала, который, например, используется для шунтирования сосудов.
Эфиры целлюлозы применяются во многих сферах человеческой деятельности, в том числе в процессе реставрации. Их функция заключается в проклеивании и укреплении изделия. Они применяются при восстановлении бумажных материалов, живописи, тканей. Существует особая методика, заключающаяся в опускании ветхой бумаги в слабый (2%) раствор метилцеллюлозы. Эфиры данного полимера являются устойчивыми к действию химических реагентов и экстремальных условий окружающей среды, негорючи, поэтому применяются для придания прочности каким-либо материалам.