Содержание
-
Слайд 1
Выполнили: Патренкина Наталия, Иванова Кристина, ученицы 9«А» класса СОШ №6 Руководитель: Овсяникова Марина Александровна, учитель химии СОШ №6
-
Слайд 2
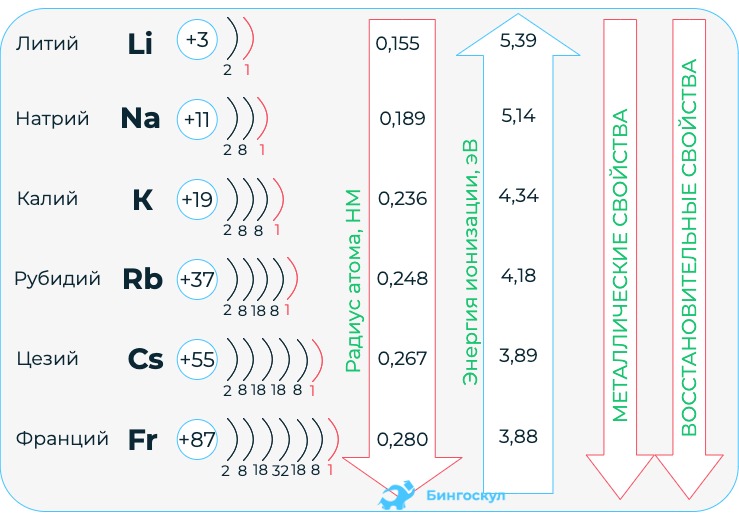
Щелочные металлы – это элементы главной подгруппы I группы Периодической системы химических элементов Д.И. Менделеева: литий(Li), натрий(Na), калий(K), рубидий(Rb), цезий(Cs), франций(Fr). На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1.
-
Слайд 3
Li +3 2 1 1s2 1s2 2s1 ЭГФ: 2s1
-
Слайд 4
Na +11 2 8 1 ЭГФ: 1s2 1s2 2s2 2s2 2p6 2p6 3s1 3s1
-
Слайд 5
К +19 2 8 8 1 1s2 2s2 2p6 3s2 3p6 4s1 ЭГФ: 1s2 2s2 2p6 3s2 3p6 4s1
-
Слайд 6
-
Слайд 7
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите, а затем в сподумене и в лепидолите. Металлический литий впервые получил Хамфри Дэви в 1825 году.
-
Слайд 8
Натрий впервые был получен английским химиком Хемфри Дэви в 1807 году электролизом твердого NaOH.
-
Слайд 9
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий». В 1809 году Л. В. Гильберт предложил название «калий».
-
Слайд 10
В 1861 году немецкие учёные Роберт Вильгельм Бунзен и Густав Роберт Кирхгоф, изучая с помощью спектрального анализа природные алюмосиликаты, обнаружили в них новый элемент, впоследствии названный рубидием по цвету наиболее сильных линий спектра.
-
Слайд 11
Цезий был открыт в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом в водах Дюрхгеймского минерального источника в Германии методом оптической спектроскопии, тем самым, став первым элементом, открытым при помощи спектрального анализа. В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (CsCN) и бария.
-
Слайд 12
Этот элемент был предсказан Д. И. Менделеевым (как Эка-цезий), и был открыт (по его радиоактивности) в 1939 г. Маргаритой Перей, сотрудницей Института радия в Париже. Она же дала ему в 1964 г. название в честь своей родины — Франции.
-
Слайд 13
Уравнения реакций щелочных металлов с неметаллами – водородом и серой: 2М+Н2= 2МН 0 0 t +1 -1 2е гидрид 2М+S= М2S 2е 0 0 t +1 -2 сульфид
-
Слайд 14
При взаимодействии с кислородом натрий образует не оксид, а пероксид: 2Na+O2 = Na2O2 0 0 2е t +1 -1 пероксид И только литий образует оксид при взаимодействии с кислородом: 4Li+O2 = 2Li2O 0 0 +1 t -2 2e оксид лития
-
Слайд 15
Все щелочные металлы активно взаимодействуют с водой, образуя щелочи и восстанавливая воду до водорода: 2М+2НОН = 2МОН+Н2 +1 +1 0 0 2е
-
Слайд 16
Оксиды М2О – твердые вещества. Имеют ярко выраженные основные свойства: взаимодействуют с водой, кислотами и кислотными оксидами. Оксиды натрия Na2O и калия K2O получают, прокаливая пероксиды с соответствующими металлами, например: 2Na + Na2O2 = 2Na2O +1 2e -2 t -1 +1 0
-
Слайд 17
Гидроксиды МОН – твердые белые вещества. Очень гидроскопичны. Хорошо растворяются в воде, с выделением большого количества теплоты. Их относят к щелочам. Гидроксид натрия NaOH в технике известен как едкий натр, каустическая сода, каустик. Техническое название гидроксида калия KOH – едкое кали. Едкий натр применяют для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства жидкого мыла. Едкое кали применяют для производства жидкого мыла.
-
Слайд 18
Карбонат натрия образует кристаллогидрат Na2CO3*10H2O, известный под названием кристаллическая сода, которую применяют в производстве стекла, бумаги, мыла.
-
Слайд 19
Гидрокарбонат натрия применяют в пищевой промышленности (пищевая сода) и в медицине (питьевая сода)
-
Слайд 20
Карбонат калия (техническое название поташ) применяют в производстве жидкого мыла и для приготовления тугоплавкого стекла, а также в качестве удобрения.
-
Слайд 21
Кристаллогидрат сульфата натрия (техническое название глауберова соль) применяют для производства соды и стекла и в качестве слабительного.
-
Слайд 22
Хлорид натрия, или поваренная соль является важнейшим сырьем в химической промышленности, его широко применяют и в быту.
-
Слайд 23
Применение калия
Калий поддерживает работу сердечной мышцы, поэтому нехватка калия в организме отрицательно сказывается на здоровье человека. Калий необходим растениям, при его недостатке снижается интенсивность фотосинтеза. Взрослый человек должен в сутки употреблять с пищей 3,5 г калия. Больше всего калия содержат курага, соя, фасоль, зеленый горошек, чернослив, изюм и некоторые другие продукты. Соли калия широко используют в сельском хозяйстве в качестве калийных удобрений.
Посмотреть все слайды
Общая структура электронной оболочки
У щелочных металлов, таких как литий (Li), натрий (Na), калий (K) и другие, общая структура электронной оболочки характеризуется наличием одного электрона на внешнем энергетическом уровне. Это делает их очень активными химическими элементами, способными быстро вступать в реакции с другими веществами.
В электронной оболочке щелочных металлов обычно находятся два энергетических уровня. На внутреннем энергетическом уровне находятся 2 электрона, а на внешнем — только 1. В связи с этим, электронная формула каждого щелочного металла имеет вид: 2n^2, где n — порядковый номер элемента в периодической системе Менделеева.
Такая структура электронной оболочки определяет высокую химическую реактивность щелочных металлов. Одним из примеров такой реактивности является способность этих металлов реагировать с водой, образуя щелочи и выделяя водород газ. Это реакция обусловлена стремлением щелочных металлов достичь электронной конфигурации инертного газа, имеющего полностью заполненные энергетические уровни.
Стоит также отметить, что по мере движения по периоду щелочных металлов, происходит увеличение размеров атомов и энергетических уровней. Это связано с добавлением одного электрона на каждый очередной элемент и увеличением количества электронных оболочек. При этом, химические свойства щелочных металлов схожи, но некоторые различия всё же присутствуют.
Химические свойства щелочных металлов: взаимодействие, получение
Щелочные металлы находятся в первой группе периодической таблицы. Атомы этих элементов содержат один электрон на внешнем энергетическом уровне. Он расположен на большом расстоянии от ядра. Как и все металлы являются восстановителями и легко отдают электрон. Характерна степень окисления равная +1. В группе сверху вниз наблюдается увеличение металлических свойств. За счет растущей энергии ионизации способность отдавать электроны, а следовательно, электроотрицательность возрастают снизу вверх.
Франций является самым активным металлом, так как у него электрон находится на самом далеком расстоянии от ядра. Соответственно, его способность к восстановлению самая высокая.
- В нормальных условиях щелочные металлы взаимодействуют с кислородом. Они очень активны в таких реакциях, поэтому их хранят под слоем вазелинового масла. Продукты реакции могут быть оксидами или пероксидами.
4Li + O2 → 2Li2O 2Na + O2 → Na2O2
- Щелочные металлы вступают с водой в реакцию при нормальных условиях. Водород вытесняется из воды, и в качестве продукта реакции образуется растворимое основание – щелочь. Для распознавания щелочи можно использовать индикатор — фенолфталеин. При добавлении в раствор он окрашивается в малиновый цвет. Реакции с водой протекают очень бурно, литий «взрывается» в воде, натрий «кипит». При этом водород выделяется в виде белого пара клубами.
- Вступают в реакции с галогенами, образуя галогениды.
2K + Cl2 → 2KCl 2Na + Cl2 → 2NaCl
- Характерно взаимодействие с водородом при нагревании, продуктом реакции являются гидриды. Например, продуктом реакции калия и водорода будет гидрид калия.
- С серой при нагревании образуют сульфиды. Это твердое, бесцветное вещество, растворимое в воде.
2Na + S → Na2S
- При нагревании происходит реакция с фосфором, фосфиды являются продуктом.
3K + P → K3P
- Литий и натрий могут вступать в реакцию с углеродом при нагревании. В результате образуются карбиды. Остальные щелочные металлы в эти реакции не вступают.
2Li + 2C → Li2C2
- С азотом при обычных условиях реагирует только литий, с остальными щелочными металлами реакция возможна только при нагревании.
6Li + N2 → 2Li3N
- Взаимодействуют со спиртами, образуя алкоголяты.
Многие щелочные металлы способны взаимодействовать с разбавленными кислотами до образования водорода. Однако, реакция протекает стадийно, т.е. сначала металл реагирует с водой до образования щелочи, а затем происходит нейтрализация щелочи кислотой. Взаимодействие с кислотами сопровождается взрывом и поэтому такие реакции на практике не проводятся.
Получение
- Основным методом получения щелочных металлов является электролиз галогенидных расплавов. При этом чаще всего используются хлориды, входящие в состав природных минералов.
- Другими способами получения щелочных металлов могут быть получение из его оксидов и солей.
Например, натрий можно получить путем кальцинирования соды с углем.
Литий получают из его оксида при повышении температуры до 300°С.
2Li2O + Si + 2CaO → 4 Li + Ca2SiO4
Химические свойства щелочноземельных металлов: взаимодействие, получение
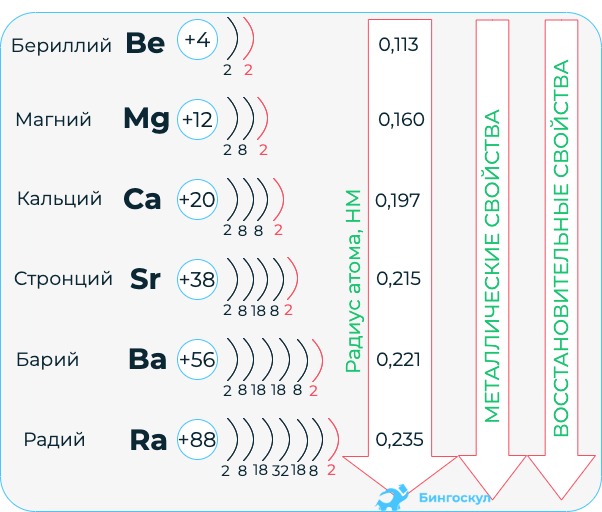
Главную подгруппу второй группы периодической системы химических элементов образуют металлы, которые получили название щелочноземельных. Так названы они потому, что гидраты их окислов («земель»), подобно гидратам окислов щелочных металлов, являются щелочами.
Внешний электронный слой их атомов состоит из двух электронов. Отдавая их, атомы этих металлов превращаются в ионы, несущие две единицы положительного заряда. Во всех своих соединениях металлы подгруппы бериллия положительно двухвалентны. В периодической таблице они соседствуют с щелочными металлами. Поэтому эти элементы проявляют высокую химическую активность, уступая в ней только щелочным металлам. Свойства металла повышаются с увеличением порядкового номера.
- Вступают в реакции с кислородом, продуктом реакции становятся оксиды, исключение барий, он образует пероксид BaO2. Бериллий и магний взаимодействуют с кислородом только при очень высоких t, так как покрыты тонкой защитной оксидной пленкой.
2Ca + O2 → 2CaO
В приведенной выше реакции кусочек кальция сгорает с образованием белого дыма при нагревании. Он образован тончайшими твердыми частицами оксида кальция.
- Подобно щелочным металлам взаимодействуют с водой, но менее активно. В результате образуется гидрат оксида и вытесняется водород.
Фенолфталеин окрашивается в полученном растворе в малиновый цвет. Этот пример оправдывает ожидаемое сходство в химических свойствах щелочноземельных и щелочных металлов: оба взаимодействуют с водой с выделением водорода. Гидраты оксидов щелочноземельных металлов, как и щелочи, являются щелочами, то есть они растворимы в воде.
- Все металлы, кроме бериллия, вступают в реакцию с галогенами. Бериллий взаимодействует с галогенами только при повышенных температурах. Продуктом реакции являются галогениды.
Ca + Cl2 → CaCl2
- При нагревании с водородом реагируют все щелочноземельные металлы, кроме бериллия. В результате образуются гидриды.
Ca + H2 → CaH2
- Реагируют с серой, в результате чего образуются сульфиды.
Ca + S → CaS
-
Взаимодействуют с азотом при нагревании, за исключением магния. Он реагирует с азотом в нормальных условиях. Продуктом реакции являются нитриды.
3Be + N2 → Be3N2 3Mg + N2 → Mg3N2
- Могут вступать в реакции с кислотами, в результате образуют соли соответствующей кислоты и водород.
Получение
Основными способами получения металлов второй группы главной подгруппы являются электролиз расплавов, алюминотермия и вытеснение из их солей другими более активными металлами.
CaO + Al → Al2O3 + Ca
MgBr2 + Ca → CaBr2 + Mg
Франций
Этот элемент открыла (по его радиоактивности) в 1939 г. сотрудница Института радия в Париже Маргарита Перей (1909—1975), а название ему она дала в честь своей родины в 1946 г.
Франций — сосед цезия по Периодический системе элементов. Д. И. Менделеев так и назвал не открытый тогда еще элемент — экацезием. Этот последний и самый тяжелый щелочной металл разительно отличается от всех других в его группе. Во-первых, никто никогда не видел и не увидит даже мельчайший кусочек франция. Во-вторых, у франция нет таких физических свойств, как плотность, температура плавления и кипения. Так что термин «самый тяжелый металл» можно отнести только к его атомам, но не к простому веществу. И все по-тому, что франций — искусственно полученный сильно радиоактивный элемент, самый долгоживущий его изотоп 223Fr имеет период полураспада всего 22 минуты. А чтобы изучить физические свойства вещества, нужно иметь его в виде хотя бы самого маленького кусочка. Но для франция это невозможно.
Маргарита Перей — первая женщина, избранная (в 1962 г.) во Французскую академию наук.
Франций получают искусственно. И по мере синтеза его атомы быстро распадаются. Причем чем больше накоплено атомов, тем больше их распадается в единицу времени. Значит, чтобы просто поддерживать число атомов франция постоянным, их нужно синтезировать со скоростью не меньшей, чем скорость их распада. При синтезе франция в Дубне путем облучения урана мощным пучком протонов каждую секунду получался примерно миллион атомов этого элемента. При такой скорости синтеза скорость распада образца становится равной скорости его образования, когда число его атомов равно двум миллиардам. Это совершенно ничтожное количество вещества, его даже в микроскоп не видно.
Кроме того, эти атомы не собраны в кусочек металла, а распределены по поверхности урановой мишени. Так что неудивительно, что во всем земном шаре в любой момент наберется не более двух—трех десятков граммов франция, рассеянных поодиночке в радиоактивных горных породах.
Щелочные металлы
Щелочные металлы — это элементы главной подгруппы I группы Периодической системы химических элементов Менделеева (ПСМ) (кроме водорода).
Задание 9.1. Назовите все щелочные металлы. Составьте схемы строения атомов натрия и калия. Укажите распределение их валентных электронов.
На внешнем уровне у атомов таких металлов находится по 1 электрону, но расстояние до ядра, а значит, и притяжение к нему, у этих электронов различно.
Вопрос. У какого элемента (натрия или калия) внешние электроны дальше от ядра?
Чем дальше электроны от ядра, тем слабее они притягиваются к нему, тем легче данный атом отдаёт электроны. А это означает, что металлические свойства выражены тем ярче, чем дальше валентные электроны от ядра (при прочих равных условиях). Поэтому сверху вниз в каждой главной подгруппе увеличивается число энергетических уровней в атомах, растёт металлическая активность элементов, т. е. способность их атомов отдавать электроны.
Вопрос. Какой металл более активный: натрий или калий?
Таким образом, активность щелочных металлов возрастает
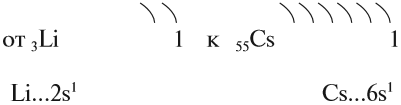
Но поскольку на внешнем уровне любого щелочного металла находится один электрон, в любой химической реакции щелочные металлы могут отдать только один электрон. Значит, они имеют постоянную валентность I и образуют оксиды состава
Этот оксид растворяется в воде, реагирует с нею:
Полученное основание — щёлочь.
Вопрос. Что такое щёлочь? (См. урок 2.3.)
В подгруппе сверху вниз увеличивается и сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Самой сильной щёлочью является CsOH.
Растворы щелочей мылкие на ощупь, разъедают кожу и ткани (щёлочи — едкие!), изменяют окраску индикаторов. Поскольку все металлы главной подгруппы I группы образуют щёлочи, — их называют «щелочные металлы».
Рассмотрим свойства щелочных металлов на примере натрия. При этом будем придерживаться схемы, изложенной начале второй части.
Строение атома Nа изображается схемой:
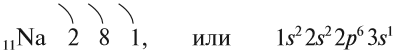
Имея один валентный электрон (…3s1), натрий является активным металлом с постоянной валентностью I:
Простое вещество «натрий» — очень лёгкий (легче воды) серебристо-белый металл, который легко режется ножом. Натрий активно реагирует с кислородом, водородом, неметаллами, водой:

Вопрос. Почему атом серы присоединил 2 электрона?
Задание 9.2. Составьте уравнения реакций натрия с хлором Cl2, азотом N2 и водой (при затруднениях см. пояснения в уроке 7).
Даже небольшие кусочки натрия (величиной с горошину) при попадании в воду вызывают оглушительный взрыв — это взрывается водород (см. урок 12). Тот же эффект будет, если натрий опустить в раствор кислоты или соли. Кроме того, здесь возможны более сложные побочные процессы. Поэтому составлять уравнения реакций для щелочных металлов в качестве примеров процессов
- металл + раствор кислоты →
- металл + раствор соли →
не рекомендуется.
Натрий образует основный оксид Nа2O, который реагирует с водой, с кислотами и кислотными оксидами (см. урок 2.1), например:
Задание 9.3. Составьте уравнения реакций оксида натрия с водой и с серной кислотой.
Гидроксид натрия NaOH (едкий натр, каустическая сода) проявляет все свойства щелочей: реагирует с кислотными оксидами, кислотами, растворами солей (см. урок 2.3), например:
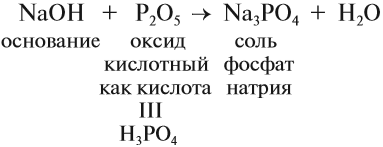
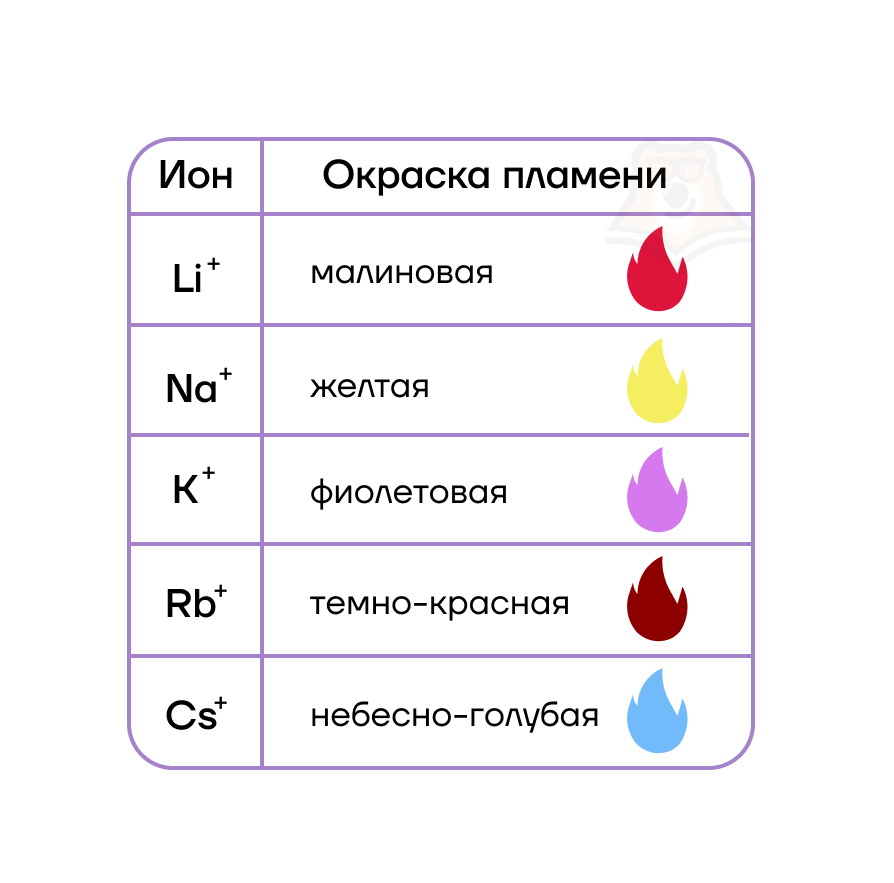
Все соединения натрия окрашивают пламя в жёлтый цвет. Это качественная реакция на соединения натрия.
Задание 9.4. Составьте уравнения реакций гидроксида натрия с хлоридом железа III, фосфорной кислотой, оксидом серы IV. (При затруднениях см. урок 2.3.)
Задание 9.5. Опишите по разобранной схеме свойства калия и его соединений.
Многие соединения натрия нашли применение в быту и промышленности. Так, каустическая сода NаОН применяется для получения мыла, в производстве алюминия, искусственных волокон и др. Кальцинированная сода Na2CO3 также применяется при получении мыла, а также при варке стекла, стирке белья и др. Но в пищу эти «соды» не употребляются! При приготовлении пищи используют питьевую соду NaHCO3 и поваренную соль NaCl. Питьевая сода используется при лечении простуды, её кладут в печенье, пирожки. Без соли NaCl почти любая еда покажется невкусной, без неё невозможно законсервировать мясо, овощи, грибы. Эти вещества применяются и в технических целях.

Химические свойства переходных металлов (меди, цинка, хрома, железа)
Переходные элементы – металлы, расположены в побочных подгруппах периодической системы химических элементов. Так как у них происходит заполнение d-уровней в последнюю очередь, то их относят к d-элементам. Если последним заполняется f-уровень, то это f-элементы. Соответственно, химические свойства обусловлены таким строением атома. Рассмотрим химические свойства некоторых переходных элементов. У всех переходных элементов наблюдается так называемый «проскок электрона», т.е. электрон может переходить на соседнюю орбиталь в пределах одного электронного слоя.
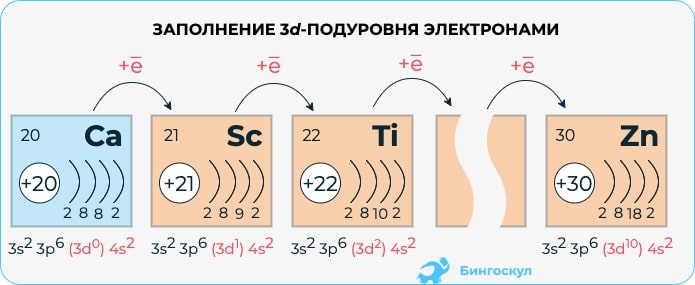
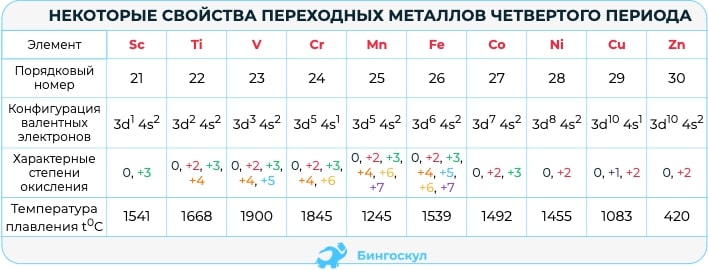
- Взаимодействие с кислородом
- В кислороде железо сгорает, разбрасывая искры – раскаленные капли железной окалины, а при накаливании на воздухе окисляется с поверхности, образуя окалину в виде корки. Во всех случаях образуется железная окалина. 3Fe + 2O2 → Fe3O4
- Медь, цинк и хром вступают в реакцию с кислородом только при нагревании
2Zn + O2 → 2ZnO 4Cr + 3O2 → 2Cr2O3
- Взаимодействие с неметаллами.
- Железо способно реагировать с азотом, фосфором, углеродом и серой. Энергично реагирует при нагревании с серой, образуя сернистое железо.
Fe + S → FeS
- Медь не реагирует с водородом, азотом, углеродом и кремнием. Характерны реакции с серой при нагревании.
- При нагревании цинк взаимодействует с серой и фосфором. С водородом, азотом, бором, кремнием, углеродом цинк в реакции не вступает.
Zn + S → ZnS
- Хром взаимодействует с азотом, серой, бором, углеродом и кремнием при повышенных температурах.
2Cr + 3C → Cr2C3
- Железо способно реагировать с азотом, фосфором, углеродом и серой. Энергично реагирует при нагревании с серой, образуя сернистое железо.
- Взаимодействие с галогенами
- Железный порошок, предварительно нагретый и внесенный в колбу с хлором, сгорает, образуя бурый дым – хлорное железо.
3Cl2 + 2Fe → 3FeCl2
- Медь и хром с галогенами вступает в реакции при нагревании.
Cu + Br2 → CuBr2 2Cr + 3Cl2 → 2CrCl3
- Цинк вступает в реакции с галогенами при нормальных условиях, в качестве катализатора необходимы пары воды.
Zn + Cl2 → ZnCl2
- Железный порошок, предварительно нагретый и внесенный в колбу с хлором, сгорает, образуя бурый дым – хлорное железо.
- При нагревании характерно взаимодействие с водой железа, цинка, хрома. Медь неактивный металл, поэтому с водой не реагирует.
При обычных условиях железо реагирует с парами воды и кислородом. Происходит процесс ржавления и образуется желто-бурая ржавчина – гидрат окиси железа.
3Fe + 6H2O + 3O2 → 4Fe(OH)3↓
- Взаимодействие с кислотами (подробно рассмотрено в разделе «Общие химические свойства металлов»).
- Железо, цинк и хром способны вытеснять из водных растворов солей медь и другие металлы, расположенные правее в ряду активности.
Fe + CuSO4 → Cu + FeSO4
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
Сообщение 2
Щелочные металлы — это химические элементы, которые расположены в 1А группе таблицы Менделеева. К данным металлам относятся: калий, рубидий, натрий, цезий, а также франций, литий.
Все элементы данной группы имеют лишь один электорн на своем внешнем энергетическом уровне. Следовательно, степень окисления у них будет +1. Все щелочные металлы очень похожи, так как для каждого из них характерна способность к:
- усилению восстановительных и металлических свойств
- уменьшению электропроницаемости
- увеличению радиуса атомов
Растворенные в воде (H2O) щелочные металлы образуют так называемые растворимые гидроксиды, которые называют щелочами.
Щелочные металлы в природе
Самыми распространенными элементами группы 1А являются калий и натрий. Однако, эти щелочные металлы обладают довольно высокой химической активностью, отчего встретить их в природе возможно исключительно в виде соединений. Наиболее богатыми источниками Na и K является каменная (NaCL) и некоторые другие соли. Соединения прочих металлов из данной группы встречаются крайне редко.
Калий — щелочной металл серебристого цвета. Этот элемент с легкостью вступает в реакцию с водой, в результате чего образуется щелочь. Это довольно легкий, быстроплавящийся металл. Известно, что люди с глубокой древности использовали соединения калия. Для этого они собирали золу и смачивали водой. Затем получившийся раствор фильтровали и выпаривали. В результате получался поташ — уникальное для своего времени моющее средство, содержащее калий.
Натрий — элемент, по своим химическим свойствам очень похожий на калий. Этот элемент шестой по распространенности в земной коре. В Древнем мире люди использовали соединения натрия. К примеру египтяне добывали соду(Na2CO3) в озерах Египта. С её помощью они бальзамировали трупы, готовили пищу, изготавливали краски и т. д.
Литий, рубидий, цезий — чрезвычайно редкие и рассеянные щелочные металлы серебристого цвета. Каждый из этих металлов очень легко плавится.
Франций — один из самых редких металлов на земле(реже встречается лишь астат). В земной коре содержится лишь 300-350 грамм этого радиогенного элемента.
При работе с щелочными металлами необходимо соблюдать технику безопасности, так как при взаимодействии с водой происходят реакция образования едких щелочей, что может вызвать огненную вспышку либо даже взрыв
Поэтому, важно надеть латексные перчатки и очки
Химические свойства металлов IA группы
Щелочные металлы — очень активные металлы, обладают выраженными восстановительными свойствами, легко вступают в реакции с большинством неметаллов, водой и кислотами.
- Взаимодействие с неметаллами
Как типичные восстановители, щелочные металлы могут взаимодействовать со своими противоположностями — неметаллами.
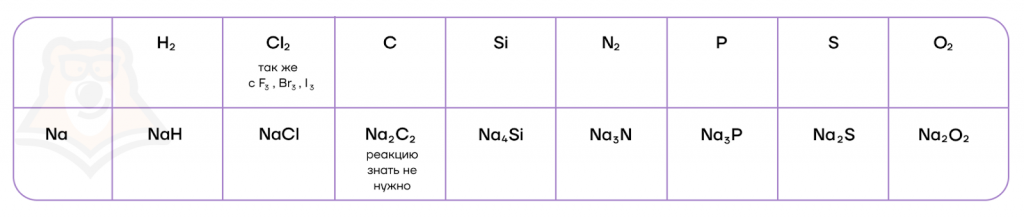
Продукты взаимодействия щелочных металлов с водородом — гидриды металлов, являются представителями редкой группы веществ, в которых водород находится в степени окисления -1, легко подвергаются гидролизу, образуя щелочь и водород, а в присутствии кислот — соль и водород.
NaH + H2O = NaOH + H2NaH + HCl = NaCl + H2
Несмотря на то, что при повышенной температуре с азотом способны взаимодействовать все щелочные металлы, легко эта реакция протекает лишь с литием (даже при комнатной температуре):
6Li + N2 = 2Li3N
Кроме того, щелочные металлы ведут себя «необычно» при взаимодействии с кислородом — в зависимости от того, какой именно из металлов вступает в реакции, образуются различные продукты.
Литий, как и подавляющее большинство металлов, образует оксид:
2Li + O2 = 2Li2O
Натрий образует пероксид — соединение с кислородом, проявляющим степень окисления -1:
2Na + O2 = Na2O2
Калий и все нижестоящие металлы образуют надпероксиды (супероксиды) — соединения, содержащие кислород, степень окисления которого условно составляет -1/2:
K + O2 = KO2
Подробнее со свойствами пероксидов можно ознакомиться в статье «Элементы VIA группы. Кислород», однако про одно свойство вспомним здесь.
| «Неорганический фотосинтез» — миф или реальность?Пероксиды щелочных металлов вступают в реакцию с углекислым газом, выделяя кислород:2Na2O2 + 2CO2 = 2Na2CO3 + O2Иногда этот процесс называют «неорганическим фотосинтезом», поскольку в ходе реакции поглощается углекислый газ и выделяется кислород, но, конечно, с настоящим фотосинтезом он не имеет ничего общего.Эта реакция находит применение, когда нужно в экстренных условиях «регенерировать» воздух — понизить концентрацию углекислого газа и повысить концентрацию кислорода, например, при авариях на подводных лодках. |
- Взаимодействие с водой
Щелочные металлы относятся к активным металлам и взаимодействуют с водой, вытесняя из нее водород.
Реакция щелочных металлов с водой протекает очень бурно и может сопровождаться взрывом.
2Na + 2H2O = 2NaOH + H2

| Почему щелочные металлы не берут в реакции с кислотами?При взаимодействии с растворами кислот щелочные металлы легко вступают во взаимодействии не только с растворенной кислотой (соляной, например), но и с молекулами воды:2Na + H2O = 2NaOH + H22Na + 2HCl = 2NaCl + H2Реакция протекает очень бурно, сопровождается взрывом, а кто хочет, чтобы при взрыве его еще и раствором кислоты обрызгало…Кстати, щелочь, образующаяся при взаимодействии щелочного металла с водой (если вам удалось не расплескать реакционную смесь), вступает в реакцию с растворенной кислотой, образуя соль и воду, так что конечным продуктом при взаимодействии щелочных металлов с растворами кислот, все равно будут соль и водород.NaOH + HCl = NaCl + H2O |
- Взаимодействие с аммиаком
Кроме того, что щелочные металлы способны к взаимодействию с водой, они могут вступать в реакции и с аммиаком, в состав которого, как и в состав воды, входят атомы водорода в степени окисления +1. При взаимодействии щелочных металлов с аммиаком образуются соответствующие амиды и водород.
2Na + 2NH3 = 2NaNH2 + H2
Образующиеся в ходе реакции амиды подвержены гидролизу:
NaNH2 + H2O = NaOH + NH3NaNH2 + 2HCl = NaCl + NH4Cl
- Взаимодействие с оксидами и галогенидов металлов
Щелочные металлы способны восстанавливать менее активные металлы из их оксидов и галогенидов при нагревании.
2Na + CuO = Cu + Na2O3K + AlCl3 = Al + 3KCl
Применим полученные знания на практике — разберем задание №9 из ЕГЭ.Задание.Задана следующая схема превращений.
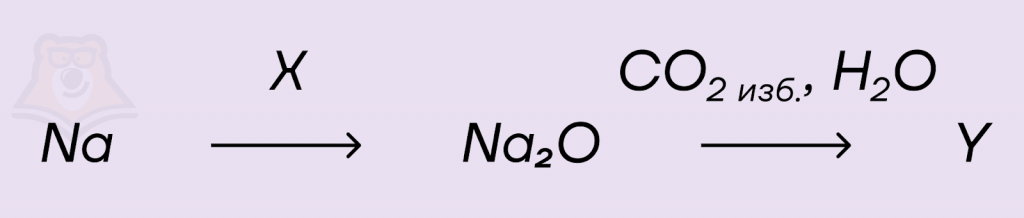
Определите, какие из предложенных веществ являются веществами X и Y:1. Na2C22. Na2CO33. NaHCO34. FeO5. O2Решение.Оксид натрия нельзя получить прямым синтезом, но можно в ходе восстановления оксидов других металлов, тогда вещество X — FeO:2Na + FeO = Na2O + FeПри действии избытка водного раствора углекислого газа на оксид натрия образуется кислая соль, а значит вещество Y — NaHCO3:Na2O + 2CO2 + H2O = 2NaHCO3Ответ: 43
| Как можно распознать катионы щелочных металлов?Как же можно отличить катионы щелочных металлов друг от друга? Самый простой и распространенный метод — по окраске цвета пламени! Соединения этих металлов придают пламени характерные цвета, которые приведены в таблице. Кстати, это свойство используют в пиротехнике при изготовлении смесей для салютов и фейерверков. |
Применение
Простые металлы и их соединения используются для изготовления лёгких сплавов, металлических деталей, удобрений, соды и других веществ. Рубидий и калий используются в качестве катализаторов. Пары натрия применяются в люминесцентных лампах. Не имеет практического применения только франций из-за радиоактивных свойств. Как используют элементы I группы кратко описано в таблице применения щелочных металлов.
|
Область применения |
Применение |
|
Химическая промышленность |
– Натрий ускоряет реакцию при производстве каучука; – гидроксид калия и натрия – производство мыла; – карбонат натрия и калия – изготовление стекла, мыла; – гидроксид натрия – изготовление бумаги, мыла, ткани; – нитрат калия – производство удобрений |
|
Пищевая промышленность |
– Хлорид натрия – поваренная соль; – гидрокарбонат натрия – питьевая сода |
|
Металлургия |
Калий и натрий являются восстановителями при получении титана, циркония, урана |
|
Энергетика |
– Расплавы калия и натрия используются в атомных реакторах и авиационных двигателях; – литий используется для производства аккумуляторов |
|
Электроника |
Цезий – производство фотоэлементов |
|
Авиация и космонавтика |
Сплавы из алюминия и лития используются для корпусов машин и ракет |
Рис. 3. Питьевая сода.
Что мы узнали?
Из урока 9 класса узнали об особенностях щелочных металлов. Они находятся в I группе таблицы Менделеева и при реакциях отдают один валентный электрон. Это мягкие металлы, легко вступающие в химические реакции с простыми и сложными веществами – галогенами, неметаллами, кислотами, водой. В природе встречаются только в составе других веществ, поэтому для их извлечения используется электролиз или реакция восстановления. Применяются в промышленности, строительстве, металлургии, энергетике.
-
/10
Вопрос 1 из 10
атомные и физические свойства щелочных металлов
| Атомный номер | Название, символ | Число природных изотопов | Атомная масса | Энергия ионизации , кДж·моль −1 | Сродство к электрону , кДж·моль −1 | ЭО | Δ H дисс , кДж·моль −1 | Металл. радиус, нм | Ионный радиус (КЧ 6), нм | t пл ,°C | t кип ,°C | Плотность ,г/см³ | Δ H пл , кДж·моль −1 | Δ H кип , кДж·моль −1 | Δ H обр , кДж·моль −1 |
| 3 | Литий Li | 2 | 6,941(2) | 520,2 | 59,8 | 0,98 | 106,5 | 0,152 | 0,076 | 180,6 | 1342 | 0,534 | 2,93 | 148 | 162 |
| 11 | Натрий Na | 1 | 22,989768(6) | 495,8 | 52,9 | 0,99 | 73,6 | 0,186 | 0,102 | 97,8 | 883 | 0,968 | 2,64 | 99 | 108 |
| 19 | Калий К | 2+1 а | 39,0983(1) | 418,8 | 46,36 | 0,82 | 57,3 | 0,227 | 0,138 | 63,07 | 759 | 0,856 | 2,39 | 79 | 89,6 |
| 37 | Рубидий Rb | 1+1 а | 85,4687(3) | 403,0 | 46,88 | 0,82 | 45,6 | 0,248 | 0,152 | 39,5 | 688 | 1,532 | 2,20 | 76 | 82 |
| 55 | Цезий Cs | 1 | 132,90543(5) | 375,7 | 45,5 | 0,79 | 44,77 | 0,265 | 0,167 | 28,4 | 671 | 1,90 | 2,09 | 67 | 78,2 |
| 87 | Франций Fr | 2а | (223) | 380 | (44,0) | 0,7 | — | — | 0,180 | 20 | 690 | 1,87 | 2 | 65 | — |
| 119 | Унуненний Uue |
Радиоактивные изотопы: 40K, T1/2 = 1,277·109 лет; 87Rb, T1/2 = 4,75·1010 лет; 223Fr, T1/2 = 21,8 мин; 224Fr, T1/2 = 3,33 мин.
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Многие минералы содержат в своём составе щелочные металлы. Например, ортоклаз, или полевой шпат, состоит из алюмосиликата калия K2, аналогичный минерал, содержащий натрий — альбит — имеет состав Na2. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl·KCl, карналлит KCl·MgCl2·6H2O, полигалит K2SO4·MgSO4·CaSO4·2H2O.
Химические свойства щелочных металлов Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту (Li) их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.





























