39.190. Углеводороды – алканы, алкены, циклоалканы
Алканы и циклоалканы
Алканы (предельные или насыщенные углеводороды, парафины) — углеводороды, атомы углерода в которых соединены простыми связями. Общая формула: CnH2n+2. Соотношение числа атомов водорода и углерода в молекулах алканов максимально по сравнению с молекулами углеводородов других классов.
|
Алканы |
Ряд метана |
|
Формула |
Название |
|
СН4 |
Метан |
|
С2Н6 |
Этан |
|
С3Н8 |
Пропан |
|
С4Н10 |
Бутан |
|
С5Н12 |
Пентан |
|
С6Н14 |
Гексан |
|
С7Н16 |
Гептан |
|
С8Н18 |
Октан |
|
С9Н20 |
Нонан |
|
С10Н22 |
Декан |
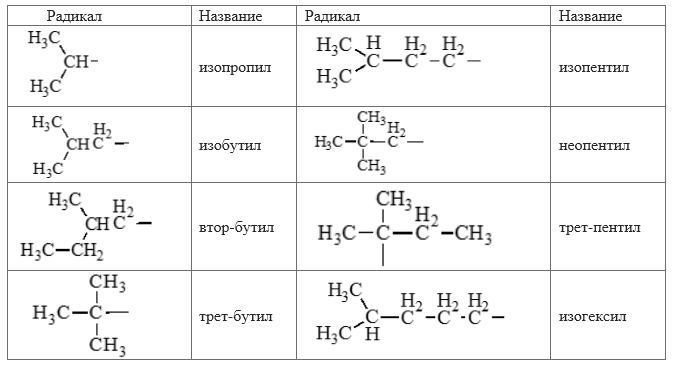
Таблица изомеров и название радикалов
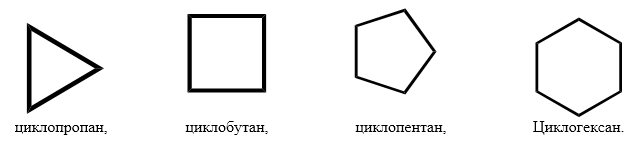
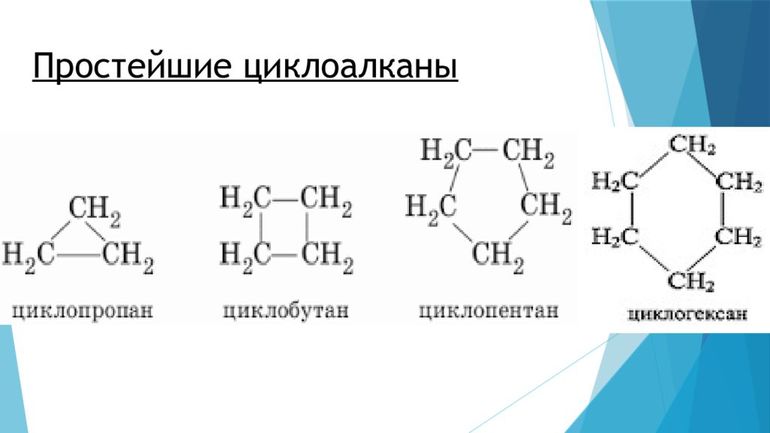
При замыкании углеводородной цепи в цикл с потерей двух атомов водорода образуются моноциклоалканы с общей формулой CnH2n. Циклизация начинается с C3, названия образуются от Cn с префиксом цикло–:
Изомерия алканов и циклоалканов:
1. Углеродного скелета
Пространственные изомеры могут быть у циклоалканов:
Конформеры находятся в динамическом равновесии и превращаются друг в друга через нестабильные формы. Неустойчивость плоских циклов вызвана значительной деформацией валентных углов. При сохранении тетраэдрических валентных углов для циклогексана C6H12 возможны две устойчивые конформации: в форме кресла и в форме ванны:
Химические cвойства алканов
1. Галогенирование:
СH4+Cl2=CH3Cl+HCl
2. Нитрование:
3. Реакции горения:
С5H12+8O2=5CO2+6H2O
4. Сульфохлорирование:
CH3(CH2)10CH3+SO2+Cl2→CH3(CH2)10CH2- SO2Cl+HCl
CH3(CH2)10CH2- SO2Cl+2NaOH→CH3(CH2)10- CH2SO3Na+NaCl
Это свойство используется при получении синтетических моющих средств.
Химические свойства циклоалканов
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения.
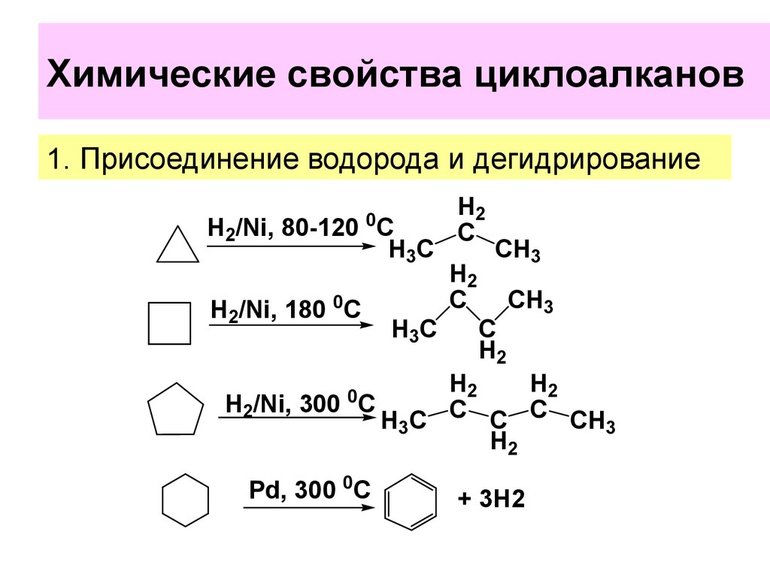
1. Малые циклы (С3 — С4) довольно легко вступают в реакции гидрирования:
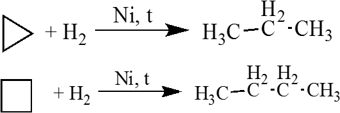
Циклопропан и его производные присоединяют галогены и галогеноводороды:
В других циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.
2. Эти соединения, подобно алканам, вступают также в реакции дегидрирования, окисления в присутствии катализатора и др.
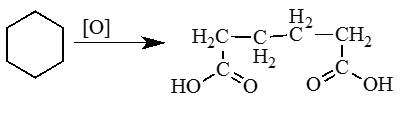
3. Окисление циклоалканов (циклогексан).
Столь резкое отличие в свойствах циклоалканов в зависимости от размеров цикла приводит к необходимости рассматривать не общий гомологический ряд циклоалканов, а отдельные их ряды по размерам цикла. Например, в гомологический ряд циклопропана входят: циклопропан С3Н6, метилциклопропан С4Н8, этилциклопропан С5Н10 и т.д.
Алкены
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.
|
Алкены |
Ряд этилена |
|
Формула |
Название |
|
С2Н4 |
Этен |
|
С3Н6 |
Пропен |
|
С4Н8 |
Бутен |
|
С5Н10 |
Пентен |
|
С6Н12 |
Гексен |
|
С7Н14 |
Гептен |
|
С8Н16 |
Октен |
|
С9Н18 |
Нонен |
|
С10Н20 |
Декен |
Виды изомерии:
Помимо изомерии, связанной со строением углеродной цепи, в ряду олефинов наблюдается изомерия положения двойной связи. Кроме того, у олефинов имеет место пространственная (геометрическая) или цис-транс-изомерия.
Для изучения материала по названному виду изомерии необходимо просмотреть анимационный фильм “Цис-транс-изомерия в ряду алкенов”
Обращаем внимание на то, что текст, сопровождающий этот фильм. в полном объеме перенесен в данный подраздел и ниже следует
Цис-транс-изомерия в ряду алкенов
Наряду с изомерией, связанной со строением углеродного скелета и положением двойной связи, в ряду алкенов имеет место геометрическая или цис-транс-изомерия. Ее существование обусловлено отсутствием свободного вращения атомов, связанных двойной связью.
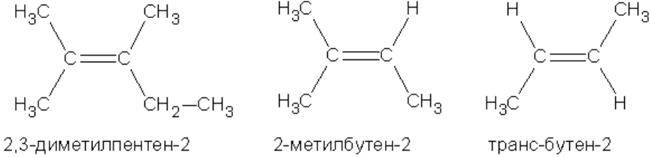
Метильные группы в приведенных примерах могут располагаться как по одну сторону двойной связи (такой изомер называется цис-изомером), так и по разные стороны (такой изомер называется транс-изомером). Названия упомянутых изомеров происходят от латинского cis — на этой стороне и trans- через, на другой стороне. Превращение изомеров друг в друга невозможно без разрыва двойной связи”.
Химические свойства алкенов:
1. Присоединение галогенов.
CH2=CH-CH3+Cl2→CH2Cl-CHCl-CH3
2. Присоединение водорода.
CH2 = CH-CH3+Н2→CH3-CH2-CH3
3. Присоединение галогенводородов.
CH2 = CH-CH3+НCl→CH3-CHCl-CH3
Присоединение протекает по правилу Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода).
4. Присоединение воды.
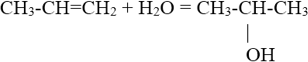
5. Окисление перманганатом калия в нейтральной или слабощелочной среде (реакция Вагнера).
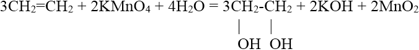
6. Полимеризация алкенов.
![]()
Прочитано
Отметь, если полностью прочитал текст
Физические свойства
В общем циклоалканы сходны по физическим свойствам к соответствующим алканам, однако имеют несколько большие температуры плавления и кипения, большие плотности. Этим они обязаны большим силам Лондона, поскольку циклическая форма способствует большей поверхности межмолекулярных контактов. Циклоалканы выражают практически такую же химическую пассивность что и алканы (содержат стойкие $C-C$ и $C-H$ связи). Однако, циклическое напряжение (см. ниже) может способствовать повышенной реактивности.
Моно циклоалканы $C3-C4$ представляют собой газы, начиная с $C5$ — жидкости.
Они также малополярны, как и алканы, и практически нерастворимы в воде и прочих полярных растворителях.
Физические свойства некоторых циклоалканов приведены в таблице ниже:
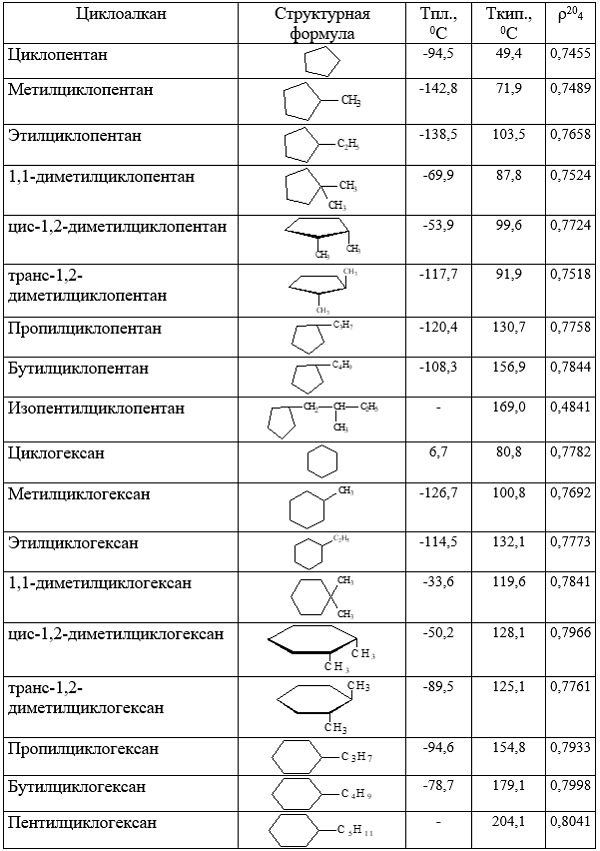 Рисунок 6. Физические свойства некоторых циклоалканов. Автор24 — интернет-биржа студенческих работ
Рисунок 6. Физические свойства некоторых циклоалканов. Автор24 — интернет-биржа студенческих работ
Примеры циклоалканов
Наконец, вернемся к началу статьи: изображению с несколькими незамещенными циклоалканами.
Чтобы запомнить циклоалканы, просто представьте себе геометрические фигуры: треугольник (циклопропан), квадрат (циклобутан), пентагон (циклопентан), гексагон (циклогексан), гептагон (циклогептан), декагон (циклодекан), пентадекагон (циклопентадекан) и так далее. ,
Чем больше кольцо, тем меньше оно напоминает соответствующую геометрическую фигуру. Уже было замечено, что циклогексан не является шестиугольником; то же самое более очевидно с циклотетрадеканом (четырнадцать атомов углерода).
Наступает момент, когда они будут вести себя как ожерелья, которые можно сложить, чтобы минимизировать напряжение их звеньев и затмения.
Материал по углубленному курсу.
Получение циклоалканов.
1. Реакция Симмонса-Смита.
Реакция Симмонса-Смита позволяет превратить двойную связь в алкенах в циклопропановое кольцо. Реакция проводится между алкеном и дийодметаном в присутствии активированной цинк-медной пары. 
Реакция проводится в эфире при 30°C. Медь не является непосредственным участником реакции, однако нужна для активации цинка.
2. Реакция Дильса-Альдера.
Собрать шестичленное кольцо можно из двух компонентов – диена и алкена. Такая реакция называется реакцией Дильса-Альдера. Алкен, который в нее вступает, также часто называют диенофилом. Процесс протекает особенно успешно, если при двойной связи в диенофиле находятся электроноакцепторные заместители, например, карбоксильные группы. Ниже показан типичный пример этой реакции, приводящей к образованию шестичленного цикла.

Как видно, в результате получается не циклоалкан, а циклоалкен, но принципиальным здесь является именно образование цикла.
Химические свойства циклоалканов.
1. Гидрирование.
В школьных учебниках обычно дается реакция гидрирования только циклопропана и циклобутана. Может создаться впечатление, что более крупные циклы в эту реакцию не вступают. Действительно, крупные циклы гидрируются гораздо труднее. Тем не менее при повышенной температуре 300°С на платиновом катализаторе можно прогидрировать циклопентан в н-пентан:

А вот гидрирование циклогексана в н-гексан провести уже очень трудно.
Помимо платиновых для гидрирования циклоалканов можно использовать никелевые катализаторы, однако они менее активны. На никелевом катализаторе превращение циклопропана в пропан происходит при 80°С (против комнатной температуры на платине), а циклобутана в бутан – при 200°С (против 50°С на платине).
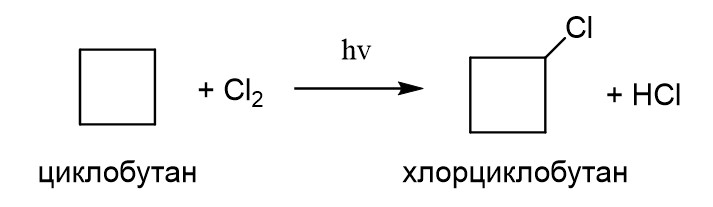
2. Галогенирование.
Мы уже говорили о том, что малые циклы легко раскрываются в реакциях с галогенами. Тем не менее если сильно снизить температуру, то возможно получение существенных количеств продуктов замещения. Например, при хлорировании циклопропана при низкой температуре можно получить хлорциклопропан наряду с продуктом присоединения 1,3-дихлорпропаном.

Хлорирование циклобутана дает преимущественно хлорциклобутан.
Физико-химические свойства
Физические свойства циклоалканов аналогичны свойствам алканов, но имеют более высокие температуры кипения, температуры плавления и более высокие плотности.
Будучи составленными только из атомов углерода и водорода, которые сами по себе не слишком различаются по электроотрицательности, молекулы циклоалкана неполярные и, следовательно, лишаются дипольного момента.
Они не могут взаимодействовать через дипольные силы, но зависят конкретно от сил, которые увеличиваются с молекулярной массой. Вот почему маленькие циклоалканы (с менее чем пятью атомами углерода) являются газообразными.
Межмолекулярные взаимодействия
С другой стороны, поскольку они представляют собой кольца, циклоалканы имеют большую площадь контакта, что благоприятствует притяжению между их молекулами. Таким образом, они сгруппированы и взаимодействуют лучше, чем алканы и, следовательно, их температура кипения и плавления выше.
Насыщение и стабильность
Почему циклоалканы классифицируются как насыщенные углеводороды? Потому что у них нет способа включить молекулу водорода. Если кольцо не будет открыто, в этом случае они станут простыми алканами. Чтобы углеводород считался насыщенным, он должен иметь максимально возможное количество связей СН.
Химическими свойствами циклоалканы очень похожи на алканы. Однако их относительная стабильность отличается, что может быть проверено экспериментально путём измерения их теплоты сгорания.
Дело в том, что циклопропан, исходя из теплоты сгорания алканов, должен иметь более низкую ΔH (471 ккал / моль), потому что это три метиленовые группы, СН 2. Но в действительности при дегидрировании они выделяют больше тепла, что отражает нестабильность, превышающую предполагаемую. Говорят, что эта избыточная энергия происходит из-за напряжённости внутри кольца.
И действительно, эти напряжения регулируют и дифференцируют реакционную способность или стабильность по отношению к алканам и специфическим реакциям. Пока напряжения не очень высоки, циклоалканы имеют тенденцию быть более стабильными, чем их соответствующие алканы.
Помимо углового натяжения, существуют и другие факторы, способствующие стрессу, испытываемому циклоалканами.
Связи CC не могут вращаться без большего, поскольку это будет означать, что вся структура будет «дрожать». Таким образом, эти молекулы могут принимать очень чётко определённые пространственные конформации. Цель этих движений состоит в том, чтобы уменьшить напряжённость, вызванную затмением атомов водорода, то есть когда они смотрят друг на друга.
Реакции и применение
Реакции, которые могут испытывать циклоалканы, такие же, как и для алканов. Оба участвуют в типичных реакциях горения с образованием углекислого газа и воды. Кроме того, оба могут испытывать галогенирование, при котором водород заменяется атомом галогена (F, Cl, Br, I). Каталитическое гидрирование, бромирование и реакция с галогеноводородами дают производные пропана. При окислении они образуют:
- CO2 и H2O;
- спирты;
- двухатомные спирты;
- дикарбоновые кислоты.

Применение циклоалканов во многом зависит от их углеродного числа. Более лёгкие и, следовательно, газообразные, когда-то служили для питания ламп общественного освещения.
Жидкие фракции используют в качестве растворителей для масел, жиров или коммерческих продуктов неполярной природы. Они также часто используются в рутинных операциях в нефтяных лабораториях или при разработке топлива.
*§ 11-1. Циклоалканы
Циклоалканы
Помимо линейных и разветвлённых цепей, атомы углерода могут образовывать циклы.
Интересно знать
Одним из первых идею о том, что атомы углерода могут образовывать циклы, высказал выдающийся немецкий химик Август Кекуле (1829–1896), разгадывая загадку строения молекулы бензола. Существует версия, что к этой идее учёного подтолкнул вид нескольких обезьян в зоопарке, схвативших друг друга за лапы и хвост. Другие историки считают, что Кекуле приснилась углеродная цепь как извивающаяся змея, которая ухватила себя за хвост, и так замерла… Это напоминает легенду о том, что Периодическую таблицу Менделеев также увидел во сне.
На схеме приведены формулы веществ, содержащих циклы из атомов углерода, связанных между собой одинарными ковалентными связями, эти вещества называются циклоалканами:
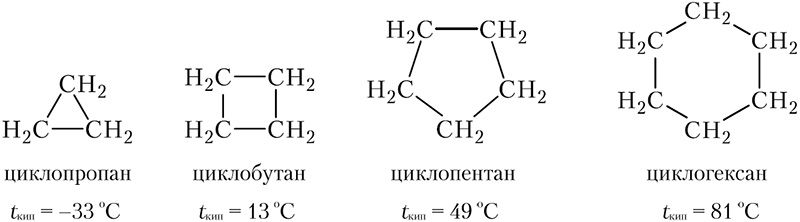
Скелетные формулы циклоалканов:
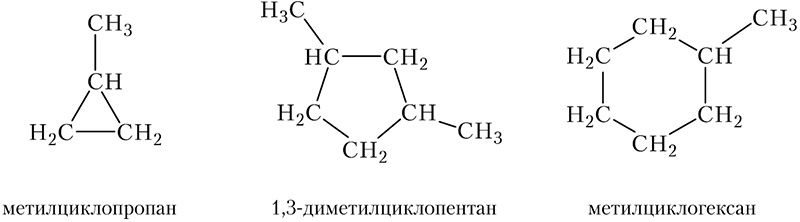
Молекулы циклоалканов могут содержать заместители, связанные с циклом:
Для замыкания открытой цепи атомов углерода в цикл необходимо отщепить от молекулы алкана два атома водорода:
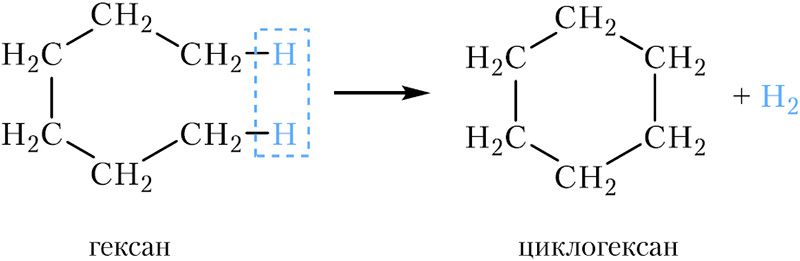
Вспомним общую формулу алканов: СnH2n+2. У циклоалканов на два атома водорода меньше, следовательно, их общая формула СnH2n+2.
Циклоалканы — органические соединения состава СnH2n, молекулы которых содержат цикл из атомов углерода, связанных между собой одинарными ковалентными связями.
Рассмотрим изомерию циклоалканов. Изомерные циклоалканы могут различаться количеством атомов углерода в цикле:
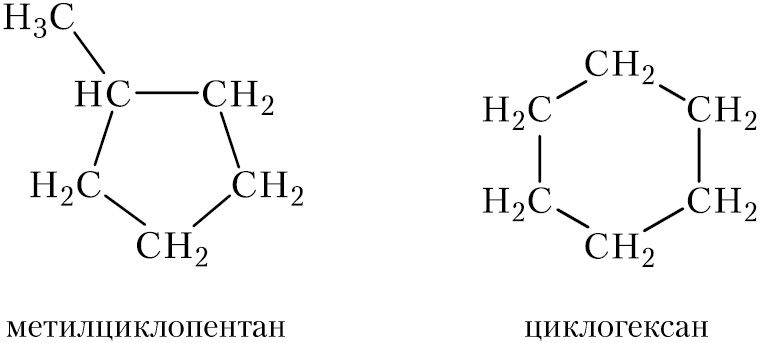
количеством заместителей в цикле и их строением:
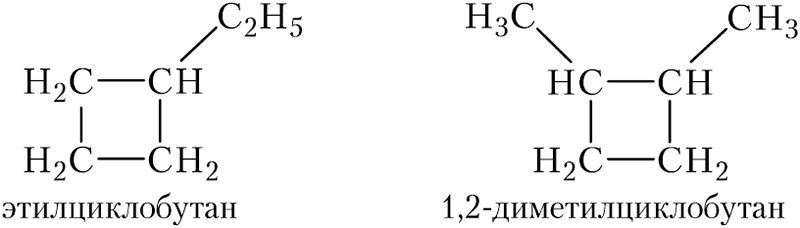
положением заместителей в цикле:

Таким образом, у циклоалканов более широкие возможности изомерии, чем у алканов. Например, существует три изомерных алкана, содержащих пять атомов углерода в молекуле:
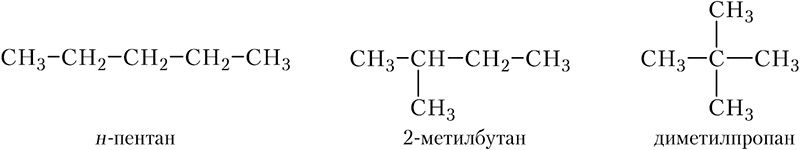
Определим число изомерных циклоалканов с тем же числом атомов углерода в молекуле, т. е. состава С5Н10. Из пяти атомов углерода можно составить пятичленный цикл:
В молекуле циклоалкана состава С5Н10 четыре атома углерода могут образовывать цикл, а один — входить в состав заместителя:
Существуют также изомерные циклоалканы состава С5Н10, молекулы которых включают цикл из трёх атомов углерода. В этом случае с циклом связаны либо две метильные группы, причём метильные группы могут находиться как у одного атома углерода, так и у соседних, либо одна этильная:
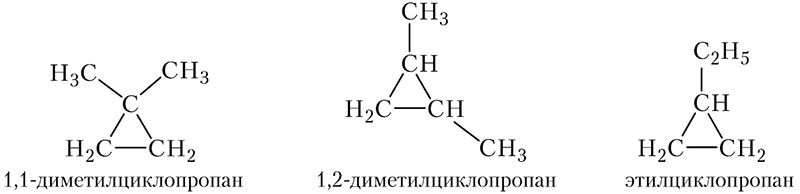
Таким образом, существуют 5 изомерных циклоалканов состава C5H12.
Рассмотрим номенклатуру циклоалканов. Основные принципы построения названий циклоалканов такие же, как и в случае алканов, только вместо наиболее длинной углеродной цепи в качестве главной цепи выбирают цикл. Атомы углерода в цикле нумеруют таким образом, чтобы заместители получили наименьшие номера. Принадлежность соединения к классу циклоалканов указывает приставка цикло- и суффикс -ан. Используя эти правила, назовём некоторые изомерные циклоалканы состава С8Н16:
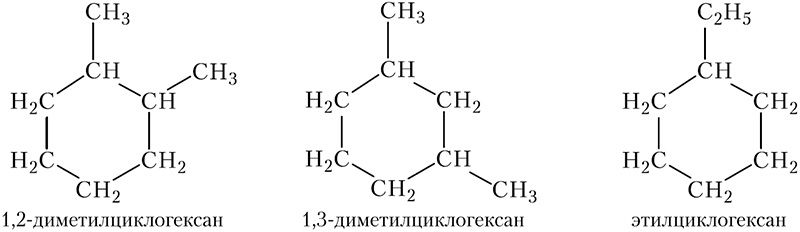
По своим физическим свойствам циклоалканы похожи на алканы. При комнатной температуре циклопропан и циклобутан — газы, циклоалканы от С5Н10 до С10Н20 — бесцветные жидкости со специфическим запахом, высшие циклоалканы являются твёрдыми веществами. Циклоалканы практически нерастворимы в воде.
Химические свойства циклоалканов с различным числом атомов углерода в цикле существенно различаются. Например, для циклопропана и циклобутана характерны реакции присоединения. Циклопентан и циклогексан, наоборот, по химическим свойствам близки к алканам: так же, как и алканы, они не реагируют с кислотами и щелочами, но для них характерны реакции замещения с галогенами. Рассмотрим химические свойства циклогексана.
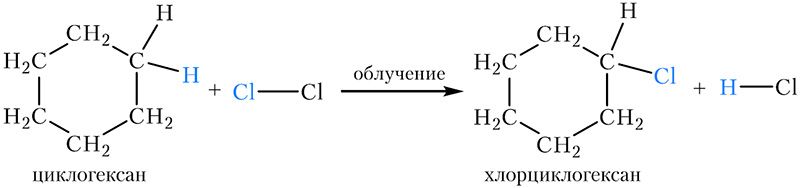
1. Галогенирование. Как и алканы, на свету циклогексан вступает в реакцию замещения с хлором и бромом:
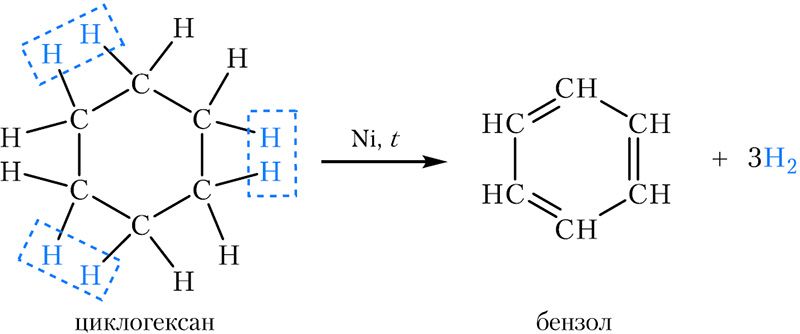
2. Дегидрирование (отщепление водорода). При пропускании паров циклогексана над нагретым никелевым, платиновым или палладиевым катализатором образуется бензол:
3. Окисление. Подобно алканам, циклогексан горит при поджигании:
C6H12 + 9O2 6CO2 + 6H2O
Циклоалканы встречаются в природе. Они входят в состав нефти, этим обусловлено ещё одно название данного класса углеводородов — нафтены. Из циклогексана получают капролактам — исходное вещество для синтеза капрона. Циклопропан применяется в медицине как обезболивающее средство.
Циклоалканы — органические соединения состава СnH2n, молекулы которых содержат цикл из атомов углерода, связанных между собой одинарными ковалентными связями.
Физические свойства циклоалканов подобные таковым для алканов.
Химические свойства циклопентана и циклогексана подобны свойствам алканов, например они вступают в реакции замещения с галогенами.
Циклоалканы встречаются в природе, они входят в состав нефти.
Основные химические и физические свойства циклоалканов
Циклоалканы обладают рядом особенностей физических свойств, таких как пластичность, высокая плотность и пониженная теплопроводность.
В тоже время, циклоалканы обладают уникальными химическими свойствами. Например, структура циклопарафинов делает их относительно неактивными в химических реакциях. В связи с этим, циклоалканы являются слабыми электронными донорами, что выражается в низкой реакционной способности данного класса соединений по сравнению с алкенами или алкинами.
Кроме того, замкнутая структура циклических парафинов не позволяет прорезаться до внутренних связей при реакциях присоединения, что также повышает неактивность данных соединений.
Способы получения соединений, применение
Циклоалканы получают путем дегидрирования алканов. При этом алканы, у которых углеродный скелет удлинен, а количество углеродных атомов в главной цепи составляет от 5 и более, нагревают в присутствии металлов, катализирующих процесс. Процесс сопровождается образованием циклических соединений.
При дегидроциклизации отщепляется водород, и образуется замкнутый цикл. Пентан и его гомологи, которые содержат пять углеродных атомов в основной цепи, при нагреве над платиновым катализатором формируют циклопентан и его гомологи:
Алканы с углеродной цепью, в которой содержится 6 и более углеродных атомов в главной цепи, в процессе дегидрирования формируют стабильные шестиатомные (шестичленные) циклы. Таким образом, происходит образование циклогексана и его гомологов.
При увеличении температуры гексан в присутствии оксида хрома (III) в зависимости от условий способен формировать циклогексан и далее бензол:
В процессе дегидрирования гептан при наличии катализатора способен формировать метилциклогексан, а затем, толуол:
Дегидроциклизация алканов является наиболее распространенным методом синтеза циклоалканов в промышленных объемах.
Образование циклогексана в процессе гидрирования бензола при повышении температуры и наличии катализатора:
Гидрирование толуола с образованием метилциклогексана:
С помощью данного метода получают исключительно циклогексан и его гомологи с шестичленным кольцом.
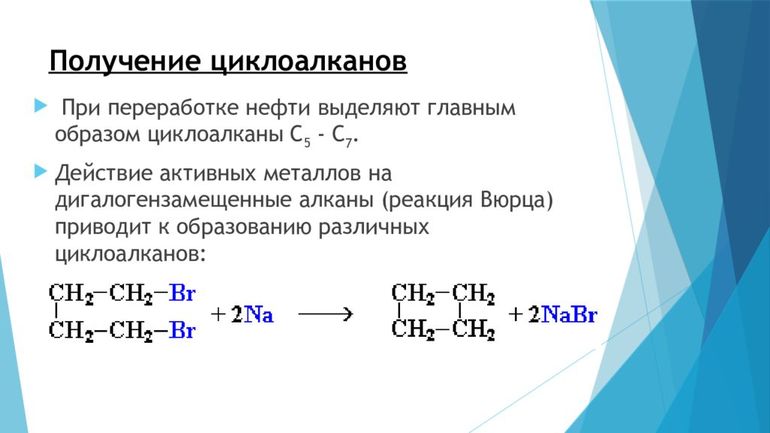
Еще одним способом получения циклоалканов является дегалогенирование дигалогеналканов. Процесс протекает под действием активных металлов. Используют дигалогеналканы, в которых между атомами галогенов размещено от трех и более углеродных атомов.
Химическая реакция 1,4-дибромбутана с цинком сопровождается образованием циклобутана:
С помощью дегалогенирования дигалогеналканов синтезируют циклоалканы определенного строения, включая циклоалканы с малыми циклами .
На промышленных предприятиях нефтехимической отрасли применяют нафтены, как сырье для производства ароматических углеводородов с помощью каталитического риформинга. Наиболее ценным с практической точки зрения является циклогексан. Данное вещество используют в синтезе таких материалов, как:
- капролактам;
- адипиновая кислота;
- другие соединения, которые используют для получения синтетических волокон.
Циклопропан используют для наркоза. Применение данного соединения имеет некоторые ограничения по причине взрывоопасности.
Циклобутан, циклопентан и их конформации
“Циклические соединения – это такие органические соединения,в которых углеродные атомы составляют замкнутые цепи, т.е. циклы. Простейшими представителями таких соединений являются циклопарафины или циклоалканы.Прочность связей в циклических соединениях зависит от числа атомов, участвующих в образовании цикла. Она определяется степенью его напряженности, обусловленной изменением валентных углов атомов цикла и отклонением этих атомов от нормального направления (см. «теорию напряжения» Байера, разработанную им в 1885 году).Для циклопропана межъядерные углы составляют 60º, как в равностороннем треугольнике, для циклобутана – 90º, как в квадрате, а в циклопентане – 108º, как в правильном пятиугольнике. Нормальный валентный угол для атома углерода – 109,5º. Поэтому при расположении в названных соединениях всех атомов углерода в одной плоскости уменьшение валентных углов составляет в циклопропане – 49,5º, в циклобутане – 19,5º, в циклопентане – 1,5º.Чем больше отклонение валентного угла от нормального, тем более напряжены и, следовательно, непрочны циклы. Однако в отличие от циклопропана циклобутан и циклопентан имеют неплоские циклы. Один из атомов углерода непрерывно выходит из плоскости. Циклобутан существует в виде неплоских «сложенных» конформаций. Циклопентан характеризуется конформацией «конверт». Таким образом, обсуждаемые циклы находятся в колебательном движении, приводящем к уменьшению «заслоненности» атомов водорода у соседних углеродных атомов и снижению напряжения.»
Структура
Оставляя в стороне замещенные циклоалканы, удобно сосредоточить внимание только на их структурных основаниях: кольцах. Они были изображены на первом изображении
Наблюдение за ними может привести к ошибочному представлению о том, что такие молекулы плоские; но, за исключением циклопропана, его поверхности имеют «зигзагообразную форму», причем угли поднимаются или опускаются относительно одной и той же плоскости.
Это связано с тем, что сначала все атомы углерода имеют sp 3 -гибридизацию и, следовательно, имеют тетраэдрическую геометрию с валентными углами 109,5 °. Но, если внимательно соблюдать геометрию колец, невозможно, чтобы их углы были такими; например, углы внутри циклопропанового треугольника составляют 60º.
Это так называемое угловое напряжение. Чем больше кольца, тем угол между связями CC приближается к 109,5 °, что вызывает уменьшение упомянутого натяжения и повышение стабильности циклоалкана.
Другой пример наблюдается в циклобутане, валентный угол которого равен 90 °. Уже в циклопентане его углы составляют 108 °, а в случае циклогексана тогда говорят, что угловое напряжение перестает оказывать столь заметный дестабилизирующий эффект.
Получение. Свойства
Физические свойства. При обычных условиях первые два члена ряда (С3 — С4) — газы, (С5 — С16) — жидкости, начиная с
C17 — твердые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов.
Получение.
1. Основной способ получения циклоалканов — отщепление двух атомов галогена от дигалогеналканов:
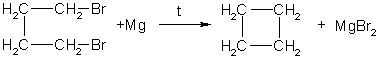
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные:
t°,P,NiC6H6 + 3H2 → C6H12.
Химические свойства. По химическим свойствам малые и обычные циклы существенно различаются между собою. Циклопропан и циклобутан склонны к реакциям присоединения, т.е. сходны в этом отношении с алкенами. Циклопентан и циклогексан по своему химическому поведению близки к алканам, так как вступают в реакции замещения.
1. Так, например, циклопропан и циклобутан способны присоединять бром (хотя реакция и идет труднее, чем с пропеном или бутеном):
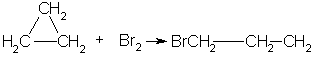
2. Циклопропан, циклобутан и даже циклопентан могут присоединять водород, давая соответствующие нормальные алканы.Присоединение происходит при нагревании в присутствии никелевого катализатора:
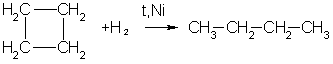
3. В реакцию присоединения с галогеноводородами опять же вступают только малые циклы. Присоединение к гомологам циклопропана происходит по правилу Марковникова:
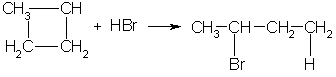
4. Реакции замещения. Обычные циклы (С6 и выше) устойчивы и вступают только в реакции радикального замещения подобно алканам:
t°С6Н12 + Вr2 → С6Н11Вr + НВr.
5. Дегидрирование циклогексана в присутствии никелевого катализатора приводит к образованию бензола:
t° Ni C6H12 → C6H6 + 3H2.
6. При действии сильных окислителей (например, 50%-ной азотной кислоты) на циклогексан в присутствии катализатора образуется адипиновая (гександиовая) кислота:
Особенности строения циклоалканов и их химическое поведение. Выше мы продемонстрировали неустойчивость малых циклов и их способность разрываться и вступать в реакции присоединения. Причины этого кроются в строении циклов. Так, циклопропан имеет плоское строение, поэтому атомы водорода у соседних атомов углерода располагаются над и под плоскостью цикла в энергетически невыгодном («заслоненном») положении. Это — одна из причин «напряженности» цикла и его неустойчивости.
Исходя из того, что трехчленный цикл является плоским равносторонним треугольником, валентные углы между атомами углерода должны быть равными 60°, т.е. резко отличающимися от величины нормального валентного утла 109,5° для классического случая sp’-гибридизации .
Установлено, что образование s-связей между атомами углерода происходит путем перекрывания sp3-гибридных орбиталей не по прямой, соединяющей ядра атомов, а вне ее.
Такое перекрывание не является осевым, характерным для образования s-связей, а несколько приближается к боковому перекрыванию, характерному для образования p-связей. Образовавшиеся s-связи с расположением максимальной электронной плотности вне прямой между ядрами связываемых атомов называют «банановыми». По свойствам они напоминают p-связи. Действительно, циклопропан способен вступать в реакции присоединения (с разрывом цикла).
Обычные циклы, наоборот, очень устойчивы и не склонны к разрыву. Так, молекула циклогексана не является плоским многоугольником и принимает различные конформации.
Среди неплоских конформаций наиболее энергетически выгодной является конформация кресла, так как в ней все валентные углы между атомами углерода равны 109,5°, а атомы водорода у соседних атомов углерода находятся относительно друг друга в заторможенном положении.
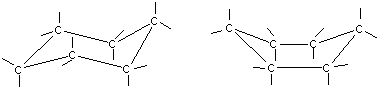
a б
Конформации шестичленного цикла: а — кресло: 6 — ванна.
Другое возможное для циклогексана расположение атомов соответствует конформации ванны, хотя оно менее устойчиво, чем конформация кресла. Следует отметить, что и в конформации кресла, и в конформации ванны связи вокруг каждого атома углерода имеют тетраэдрическое расположение. Отсюда — несравнимо большая устойчивость обычных циклов по сравнению с малыми циклами, отсюда — их возможность вступать в реакции замещения, но не присоединения.
Применение циклоалканов
Наибольшее практическое значение имеют циклопентан и циклогексан. Например, циклогексан является ценным химическим сырьём для получения циклического спирта (циклогексанола), циклического кетона (циклогексанона), двухосновной карбоновой кислоты (адипиновая, или гександикарбоновая, кислота). Из циклогексанона синтезируют капролактам — мономер для получения одного из самых известных полимеров — капрона. Циклогексан используется также в качестве растворителя. Циклопропан применяли в медицинской практике в качестве ингаляционного анестезирующего средства.
![]()
1. Напишите уравнения реакций бромирования:
а) циклопропана; б) циклогексана.
2. Напишите структурные формулы цис- и транс-изомеров:
а) 1-метил-З-этилциклогексана;
б) 1,2-диметилциклобутана.
3. Напишите структурные формулы углеводородов разных классов, отвечающих формуле С7Н14, и дайте их названия.
4. Определите строение углеводорода, если известно, что он в два раза тяжелее азота, не обесцвечивает водный раствор перманганата калия, а при взаимодействии с водородом в присутствии платины образует смесь двух веществ.
Ответ: метилциклопропан.
5. Укажите формулу 1,3-диметилциклогексана.
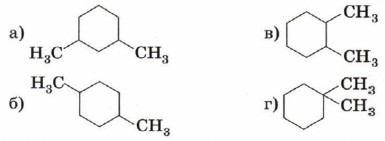
6. Какой объём раствора гидроксида калия с массовой долей КОН 11% (плотность 1,1 г/см3) потребуется для нейтрализации бромоводорода, образующегося при монобромировании 8,4 г циклогексана?
7. Какой объём водорода (н. у.) выделится при каталитическом дегидрировании 24,5 г метилциклогексана до соответствующего ароматического углеводорода, если реакция протекает с выходом 75% ?
8. Какая масса бромной воды с массовой долей Вr2 1,6% потребуется для взаимодействия со смесью 5,6 л этена и 1,12 л циклопропана (н. у.)?






























