Номенклатура спиртов
Для спиртов свойственно несколько типов номенклатуры.
Тривиальная (историческая) номенклатура. Для простых спиртовых соединений свойственны упрощенные названия. В этом случае название радикала переводят в прилагательное с помощью окончания «овый» и добавляют слово «спирт». Например, CH3-CH2-CH2-OH – пропановый спирт.
У первых двух представителей гомологического ряда есть особенные исторические названия. Метанол – древесный спирт, а этанол – винный. Такие названия обусловлены историческим методом получения. Опьяняющие свойства этанола были известны не менее чем за 8000 лет до н.э.
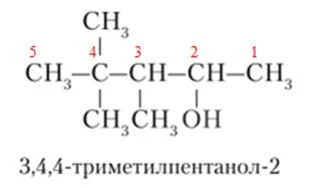
Систематическая номенклатура спиртов. Как правило, в химии используют именно этот вид номенклатуры. В одноатомных спиртах к названию радикала добавляется суффикс «ол», в двухатомных – «диол», в трехатомных – «триол». Положение гидроксигруппы обозначается наименьшим значением, если в составе спирта отсутствует карбонильная и/или карбоксильная группа.

Алгоритм названия спиртов
Систематическая номенклатура подчиняется определенному алгоритму.
- Выбор главной цепи в соединении.
- Нумерация начинается с того конца, к которому ближе функциональная группа.
- Название углеводородного радикала.
- Прибавление окончания «ол» и указание номера атома углерода, с которым связана гидроксогруппа.
Строение
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп —ОН), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на:
• одноатомные
• двухатомные (гликоли)
• трехатомные.
По характеру углеводородного радикала выделяют следующие спирты:
• предельные, содержащие в молекуле лишь предельные углеводородные радикалы
• непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода
• ароматические, т. е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода.
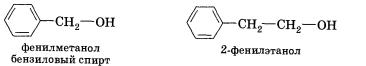
Органические вещества, содержащие в молекуле гидрок-сильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например, гидроксибензол фенол. Подробнее со строением, свойствами и применением фенолов мы познакомимся позже.
Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит).
Следует заметить, что спирты, содержащие две гидроксильные группы при одном атоме углерода, неустойчивы и самопроизвольно разлагаются (подвергаются перегруппировке атомов) с образованием альдегидов и кетонов: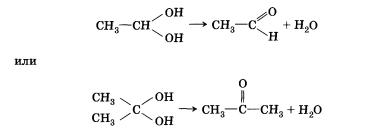
Непредельные спирты, содержащие гидроксильную группу у атома углерода, связанного двойной связью, называются еколами. Нетрудно догадаться, что название этого класса соединений образовано из суффиксов -ен и -ол, указывающих на присутствие в молекулах двойной связи и гидроксильной группы. Енолы, как правило, неустойчивы и самопроизвольно превращаются (изомеризуются) в карбонильные соединения — альдегиды и кетоны. Эта реакция обратима, сам процесс называют кето-енольной таутомерией. Так, простейший енол — виниловый спирт чрезвычайно быстро изомеризуется в уксусный альдегид.
По характеру атома углерода, с которым связана гидроксильная группа, спирты делятся на:
• первичные, в молекулах которых гидроксильная группа связана с первичным атомом углерода
• вторичные, в молекулах которых гидроксильная группа связана с вторичным атомом углерода
• третичные, в молекулах которых гидроксильная группа связана с третичным атомом углерода, например:
Номенклатура и изомерия
При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют (родовой) суффикс -ол. Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-, тетра- и т. д. — их число: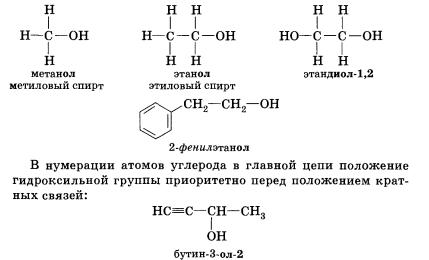
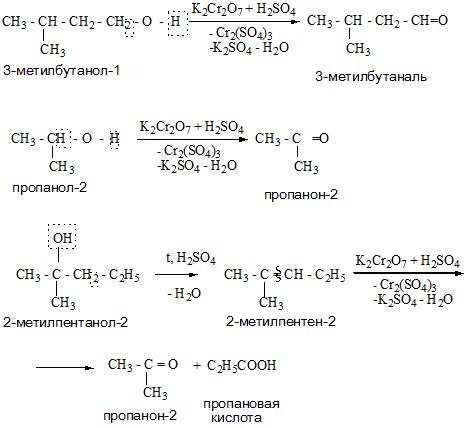
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1; 2-метилпропанол-1). Для них характерна и межклассовая изомерия — спирты изомерны простым эфирам.
Рода, входящий в гидроксильную группу молекул спиртов, резко отличается от атомов водорода и углерода по способности притягивать и удерживать электронные пары. Благодаря этому в молекулах спиртов имеются полярные связи С—О и О—Н.
Номенклатура и изомерия.
Название сложных эфиров образуется из двух частей: сначала называется радикал, который заместил водород в карбоновой кислоте, а потом называется кислотный остаток кислоты. Поэтому когда перед глазами есть структурная формула сложного эфира, необходимо выделить радикал и фрагмент кислотного остатка, после чего назвать их. На рисунке ниже мы можем выделить остаток уксусной кислоты, имеющий название «ацетат», и радикал «этил». Соединив два слова, получим название сложного эфира – этилацетат.
Можно также дать ему более длинное название: этиловый эфир уксусной кислоты. Учитывая, что уксусная кислота – это этановая кислота, то можно дать и еще одно название: этиловый эфир этановой кислоты. Наконец, поскольку соли этановой кислоты помимо ацетатов еще называют этаноатами, получаем четвертое название для нашего сложного эфира: этилэтаноат. Все четыре названия указывают на одно и то же вещество. В ЕГЭ часто специально используют разные названия.
Конечно, радикалы и кислотные остатки в сложных эфирах могут иметь более сложную структуру. Ниже показан такой пример:
Кислотный остаток здесь образован пентен-2-овой кислотой и называется он пентен-2-оат. А радикал у нас изопропиловый. Соединяем названия радикала и кислотного остатка и получаем: изопропилпентен-2-оат. Такие сложные эфиры вряд ли встретятся в ЕГЭ, разве что в задании на отнесение веществ к классам органических соединений. Но главное понимать принцип того, как составлять их названия.
Понятно, что если радикалы R1 и R2 (см. самый первый рисунок) в сложном эфире достаточно длинные, то они могут давать изомерию углеродного скелета. То есть может метиловый эфир бутановой кислоты и метиловый эфир метилпропановой кислоты.
Это изомеры, кислотный остаток в одном случае имеет неразветвленный, а другом разветвленный углеродный скелет. То же самое с радикалом. Может быть бутиловый эфир муравьиной кислоты, а может быть изобутиловый эфир муравьиной кислоты.
Также возможна изомерия положения сложноэфирной группы –СO–O–, то есть когда число атомов углерода в сложном эфире постоянно, а сложноэфирная группа смещается по углеродной цепи. Три таких изомера показаны ниже:
Наконец есть еще важный тип изомерии, знание которого часто проверяется в тестовой части ЕГЭ. Это межклассовая изомерия. У сложных эфиров есть межклассовые изомеры, а именно карбоновые кислоты. «Межклассовый» означает, что сложные эфиры и карбоновые кислоты относятся к разным классам органических соединений, но имеют одинаковую формулу гомологического ряда, а именно CnH2nO2. Ниже в качестве примера показаны этилацетат и бутановая кислота:
Для сложных эфиров, образованных из непредельной кислоты и/или содержащих непредельный радикал, возможна также изомерия положения кратной связи, а также цис-транс-изомерия.
Физические свойства спиртов
Учитывая полярность связи О—Н и значительный частичный положительный заряд, локализованный (сосредоточенный) на атоме водорода, говорят, что водород гидроксильной группы имеет «кислотный» характер. Этим он резко отличается от атомов водорода, входящих в углеводородный радикал.
Необходимо отметить, что атом кислорода гидроксильной группы имеет частичный отрицательный заряд и две неподеленные электронные пары, что дает возможность спиртам образовывать особые, так называемые водородные связи между молекулами. Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы. Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения. Так, пропан с относительной молекулярной массой 44 при обычных условиях является газом, а простейший из спиртов — метанол, имея относительную молекулярную массу 32, в обычных условиях жидкость.
Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от одного до одиннадцати атомов углерода, — жидкости. Высшие спирты (начиная с С12Н25ОН) при комнатной температуре — твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, и ок-танол уже не смешивается с водой.
Химические свойства одноатомных спиртов
1. Спирты горят, образуя углекислый газ и воду. При горении выделяется тепло.
C2H5OH + 3O2 → 2CO2 + 3H2O
2. При реакции спиртов со щелочными металлами образуется алкоголят натрия и выделяется водород.
C2H5-OH + 2Na → 2C2H5ONa + H2
3. Реакция с галогеноводородом. В результате реакции образуется галогеноалкан (бромэтан и вода).
C2H5OH + HBr → C2H5Br + H2O
4. Внутримолекулярная дегидратация происходит при нагревании и под воздействием концентрированной серной кислоты. В результате получается непредельный углеводород и вода.
Н3 – СН2 – ОН → СН2 = СН2 + Н2О
5. Окисление спиртов. При обычной температуре спирты не окисляются. Но при помощи катализаторов и при нагревании окисление происходит.
Вопросы и задания
1. Напишите общую формулу гомологического ряда, к которому относятся метиловый и этиловый спирты. В чём заключается опасность этих спиртов для организма человека?
2. Одним из представителей класса простых эфиров является диэтиловый эфир С2Н5—О—С2Н5. Диэтиловый эфир — бесцветная жидкость с характерным запахом, имеет температуру кипения, равную 35 оС. Используется в медицине для анестезии, применяется в качестве растворителя. Приведите формулы спиртов, изомерных диэтиловому эфиру.
3. Приведите названия спиртов, формулы которых:
Найдите среди названных веществ первичный, вторичный и третичный спирты. Существуют ли четвертичные спирты?
4. Приведите названия спиртов, шаростержневые модели молекул которых:

Найдите среди названных веществ первичный, вторичный и третичный спирты.
5. Напишите структурные формулы и названия восьми изомерных спиртов состава С5Н11ОН. Отнесите каждый из них к первичным, вторичным или третичным.
6*. Насыщенные одноатомные спирты и простые эфиры являются межклассовыми изомерами. Напишите структурные формулы спиртов, изомерных пропилэтиловому эфиру, назовите их по номенклатуре ИЮПАК, укажите первичные, вторичные и третичные спирты.
Спирт и его виды
Именно английское «Spirit» лежит в основании русского названия «спирт». Это вещество представляет собой органический продукт (производное углеводов), в химической формуле которого содержится гидроксильная группа. Существуют разные классификации спиртов. Согласно одной из них различают одноатомные, двухатомные и многоатомные вещества. Также химики группируют их на ненасыщенные, насыщенные и ароматические. Еще одна классификация предусматривает разделение спиртов на первичные и вторичные.
Простой спирт – это жидкость без цвета, но с характерным запахом и вкусом, легко растворяемая водой в любых пропорциях. И чем больше атомов в спиртах, тем легче они соединяются с водой. А вот для маслянистых и жиросодержащих веществ спирт и сам служит растворителем.
В природе это вещество содержится, как правило, в составе эфирных масел. В листьях многих растений содержится метиловый спирт. После брожения органических продуктов образуется этиловый спирт. Кстати, к этой категории веществ относят также и некоторые витамины, например, А, D, В8.
Химики определяют спирт, как вещество, полученное в результате гидрогенизации окиси углерода под воздействием катализаторов. Чаще всего в разных сферах жизнедеятельности используют такие спирты:
- этиловый;
- метиловый;
- фенилэтиловый.
Номенклатура
Спирты называют по систематической номенклатуре ИЮПАК (IUPAC — Международный союз теоретической и прикладной химии) по названию соответствующего углеводорода с добавлением суффикса «-ол» и цифры, которая указывает положение гидроксильной группы (- ОН). Названия углеводородов составляют в соответствии со следующими правилами:
для установления названия выбирают саму длинную углеродную цепь, установив число атомов углерода, в состав которой входит гидроксогруппа (- ОН);
- нумеруют атомы углерода в длинной углеродной цепи с того края, к которому ближе расположена гидроксильная группа;
- местоположение гидроксильной группы в названии определяют написанием цифры после суффикса «-ол»;
- если в составе спирта присутствуют другие функциональные группы, то нумерация углеродного скелета начинается с того края, где расположена старшая функциональная группа, её название указывают перед названием спирта цифрой. Например:
CH3 — CH2 — СН2 — CH2 — ОН,
пропанол-1; CH3 — CH (ОН) — СН2 — CH3, пропанол–2,
CH3 — CH(CH3) — СН2 — СН2ОН, 2-метилбутанол-1.
По радикально-функциональной номенклатуре название спиртов формируется от названия углеводородного радикала с добавлением слова «спирт», например:
СH3 — OH — метанол или метиловый спирт;
C2H5OH — этанол или этиловый спирт;
СН3 — CH2 — CH2 — СН2 — OH — бутанол или бутиловый спирт.
Тривиальные названия были даны спиртам по природному источнику получения. Например, метанол называют древесным спиртом, а этанол — винным спиртом. Тривиальные названия некоторых спиртов приведены в таблице 4.
| Химическая формула спирта | Название по номенклатуре ИЮПАК | тривиальное название |
|---|---|---|
| Предельные одноатомные спирты | ||
| CH3OH | метанол | древесный спирт |
| C2H5OH | этанол | винный спирт |
| C5H11OH | пентан-1-ол | амиловый спирт |
| C16H33OH | гексадекан-1-ол | цетиловый спирт |
| Предельные многоатомные спирты | ||
| C2H4(ОН)2 | этан-1,2-диол | этиленгликоль |
| C3H5(ОН)3 | пропан-1,2,3-триол | глицерин |
| C5H7(ОН)5 | пентан-1,2,3,4,5-пентол | ксилит |
| C6H8(ОН)6 | гексан-1,2,3,4,5,6-гексол | сорбит |
| Непредельные алифатические спирты | ||
| C3H5OH | проп-2-ен-1ол | аллиловый спирт |
| C10H17OH | 3,7-диметилокта-2,7-диен-1-ол | гераниол |
| Алициклические спирты | ||
| C6H6(OH)6 | циклогексан-1,2,3,4,5,6-гексол | инозит |
| C10H19OH | 2-(2-пропил)-5-метилциклогексанол-1 | ментол |
Применение спиртов
Так как спирты имеют разнообразные свойства, то и область из применения довольно таки обширна. Давайте с вами попробуем разобраться, где же применяются спирты.
Спирты в пищевой промышленности
Такой спирт, как этанол является основой всех алкогольных напитков. А получают его из сырья, которое содержит сахар и крахмал. Таким сырьем может быть сахарная свекла, картофель, виноград, а также разные злаковые культуры. Благодаря современным технологиям при производстве спирта происходит его очистка от сивушных масел.
В натуральном уксусе также присутствует сырье, полученное на основе этанола. Этот продукт получается благодаря окислению уксуснокислым бактериям и аэрированию.
Но в пищевой промышленности используют не только этанол, но и глицерин. Эта пищевая добавка способствует соединению несмешиваемых жидкостей. Глицерин, который входит в состав ликеров, способен придавать им вязкость и сладкий вкус.
Также, глицерин применяют при изготовлении хлебобулочных, макаронных и кондитерских изделиях.
Медицина
В медицине этанол просто незаменим. В этой отрасли он широко применяется в качестве антисептика, так как обладает свойствами, которые способны уничтожать микробы, задерживать болезненные изменения в крови и не допускают разложения в открытых ранах.
Этанолом пользуются медицинские работники перед проведением различных процедур. Этот спирт обладает свойствами обеззараживания и просушивания. При проведении искусственной вентиляции легких, этанол выступает в роли пеногасителя. А также этанол может быть одним из компонентов при анестезии.
При простуде этанол можно использовать, как согревающий компресс, а при охлаждении, как средство для растирания, так как его вещества способствуют восстановлению организма при жаре и ознобе.
В случае отравления этиленгликолем или метанолом, применение этанола способствует уменьшению концентрация токсичных веществ и выступает в роли противоядия.
Также огромную роль спирты оказывают фармакологии, так как они используются для приготовления целебных настоек и всевозможных экстрактов.
Спирты в косметике и парфюмерии
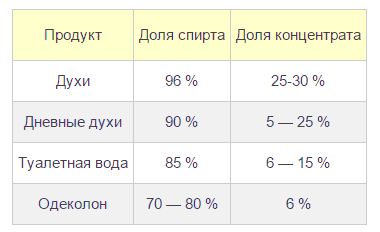
В парфюмерии без спиртов также никак не обойтись, так как основой практически всех парфюмерных продуктов является вода, спирт и парфюмерный концентрат. Этанол в этом случае выступает в роли растворителя душистых веществ. А вот 2-фенилэтанол обладает цветочным запахом и в парфюмерии может заменить натуральное розовое масло. Его применяют при изготовлении лосьонов, кремов и т.д.
Глицерин также является основой базы для многих косметических средств, так как имеет способность притягивать влагу и активно увлажнять кожу. А присутствие этанола в шампунях и кондиционерах способствует увлажнению кожных покровов и облегчает расчесывание волос после мытья головы.
Топливо

Ну а такие спиртосодержащие вещества, как метанол, этанол и бутанол-1 широко используются в качестве топлива.
Благодаря переработке такого растительного сырья, как сахарный тросник и кукуруза,
удалось получить биоэтанол, который является экологически чистым биотопливом.
В последнее время производство биоэтанола стало популярным в мире. С его помощью появилась перспектива в возобновлении топливных ресурсов.
Растворители, поверхностно-активные вещества
Кроме уже перечисленных сфер применения спиртов, можно отметить и то, что они
еще являются и хорошими растворителями. Наибольшей популярностью в этой области пользуются изопропанол, этанол, метанол. Они также используются при производстве битовой химии. Без них не возможен полноценный уход за автомобилем, одеждой, домашней утварью и т.д.
Использование спиртов в разных сферах нашей деятельности положительно влияет на нашу экономику и приносит комфорт в нашу жизнь.
Физические свойства спиртов
Учитывая полярность связи О—Н и значительный частичный положительный заряд, локализованный (сосредоточенный) на атоме водорода, говорят, что водород гидроксильной группы имеет «кислотный» характер. Этим он резко отличается от атомов водорода, входящих в углеводородный радикал.
Необходимо отметить, что атом кислорода гидроксильной группы имеет частичный отрицательный заряд и две неподеленные электронные пары, что дает возможность спиртам образовывать особые, так называемые водородные связи между молекулами. Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы. Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения. Так, пропан с относительной молекулярной массой 44 при обычных условиях является газом, а простейший из спиртов — метанол, имея относительную молекулярную массу 32, в обычных условиях жидкость.
Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от одного до одиннадцати атомов углерода, — жидкости. Высшие спирты (начиная с С12Н25ОН) при комнатной температуре — твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, и ок-танол уже не смешивается с водой.
Передозировка алкоголя
Потребление напитков, содержащих этиловый спирт, вызывает опьянение, уровень которого зависит от количества принятого алкоголя. Наличие алкоголя в организме определяют лабораторно, путем исследования крови или мочи, но передозировку спиртного заметно и по внешним признакам. Наиболее распространенные:
- путаница или бессознательное состояние;
- нарушение координации;
- тошнота и рвота;
- замедленное или прерывистое дыхание;
- потеря памяти;
- слабость.
Эффект алкогольного отравления усиливается еще больше, если принимать спирт на фоне некоторых медпрепаратов. Не стоит сочетать этанол с антидепрессантами, парацетамолом, обезболивающими или успокоительными препаратами, противосудорожными лекарствами.
И полностью отказаться от спирта важно:
- беременным;
- людям с диагнозом алкоголизм;
- при болезнях печени и поджелудочной железы;
- при сердечной недостаточности и слабом сердце;
- лицам с заболеваниями сосудов.
Понятие о фенолах
К фенолам относятся вещества, в молекулах которых гидроксогруппа ОН непосредственно связана с бензольным кольцом:
В этой молекуле ОН-группа и бензольное кольцо взаимно влияют друг на друга. Поэтому фенол по свойствам отличается и от спиртов, и от бензола. Рассмотрим примеры такого влияния.
Бензольное кольцо влияет на ОН-группу, делая её более полярной, чем у спиртов. Поэтому фенол, в отличие от спиртов, реагирует с растворами щелочей:
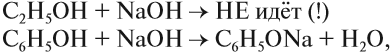
или
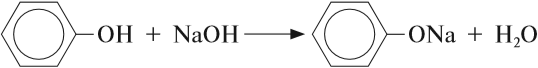
В данной реакции фенол проявляет свойства кислоты. Отсюда его второе название — карболовая кислота («карболка»). Растворы фенола изменяют окраску индикатора.
Гидроксогруппа влияет на бензольное кольцо. Фенол очень легко вступает в реакции замещения, причём, как и для толуола, реакция происходит в положениях 2, 4, 6 по отношению к гидроксогруппе:
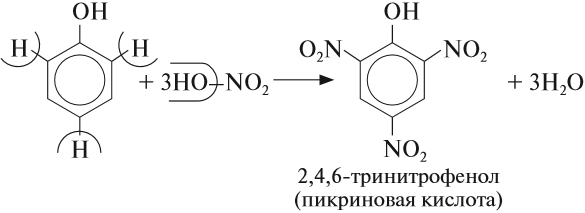
В отличие от спиртов и бензола фенол обесцвечивает бромную воду даже при нормальных условиях. Реакция протекает аналогично предыдущей.
Задание 22.9. Составьте уравнение реакции фенола с бромом и сравните эту реакцию с реакцией толуола с бромом.
Фенол легко окисляется на воздухе, при этом его белые кристаллы розовеют. Фенол сильно ядовит, так как изменяет структуру и свойства белков — основу всего живого. Кроме того, попадая в воду, он окисляется растворённым в ней кислородом. В результате содержание кислорода в водоёме уменьшается, и обитатели его погибают. Для того чтобы обнаружить фенол в водоёме и любом растворе, используют качественную реакцию с FeCl3: при добавлении этого реактива к смеси, содержащей фенол, появляется фиолетовое окрашивание.
Фенол получают из производных бензола и каменноугольной смолы. В любом случае вначале исходное вещество или смесь превращают в фенолят, а затем выделяют чистый фенол при помощи кислоты:
![]()
Фенол применяют для дезинфекции и получения красителей и полимеров.
Получение
К наиболее часто используемым химическим способам получения спиртов относятся:
- нуклеофильное замещение атомов галогенов на гидроксильные группы в галогенпроизводных (щелочной гидролиз);
- гидратация алкенов (присоединение воды по кратным связям);
- восстановление карбонильных соединений, содержащих гидроксильную группу;
- синтез спиртов из альдегидов и кетонов;
- использование реакции Гриньяра;
- гидроксилирование по Вагнеру (мягкое окисление алканов и алкенов);
- гидролиз сложных эфиров карбоновых кислот;
- кислотное расщепление простых эфиров.
Все эти методы могут быть применены как в лабораторных условиях, так и в промышленном органическом синтезе. Самый общий способ получения спиртов, имеющий промышленное значение, — гидратация алкенов. Реакция идет при пропускании алкена с парами воды над фосфорнокислым катализатором. Другой общий способ получения спиртов — гидролиз алкилгалогенидов под действием водных растворов щелочей.
К биохимическим способам получения спиртов относится спиртовое сбраживание природного сырья, содержащего углеводы (крахмал, фруктозу, сахарозу и др.) Для промышленного получения спирта в качестве сырья используют содержащие крахмал продукты — картофель, зерновые культуры, а также отходы сахарного производства. Брожение протекает под действием дрожжей, в результате чего образуются этанол и другие предельные спирты (бутиловый, изобутиловый, амиловый и изоамиловый спирты), носящие название «сивушные масла», а также некоторых групп анаэробных бактерий, под действием которых образуется преимущественно н-бутиловый спирт. Этанол получают при спиртовом брожении глюкозы:
Многоатомные спирты получают из оксосоединений, алкенов, сложных эфиров многоосновных кислот.
Одним из способов получения глицерина является омыление, гидролиз в кислой среде триацилглицеринов (сложные эфиры глицерина и высших жирных кислот) — основных компонентов липидной фракции жиров и растительных масел.
Химические свойства
По причине своего строения спирты проявляют амфотерные свойства: основные и кислотные, далее детально на них остановимся:
- Кислотные свойства спиртов проявляются в способности отщепления протона гидроксигруппы. По мере роста длины углеродной цепи, объема ее радикала, а также степени разветвления и наличия в молекуле доноров, кислотность уменьшается.
- Основные свойства спиртов являются обратными к их кислотным свойствам, так как они выражаются в их способности, наоборот, присоединить протон.
Алкоголи и гликоли имеют особенность вступать в химические реакции замещения, отщепления и окисления. Опишем их детальнее:
- Реакции замещения протекают с образованием солей (алкоголятов и гликолятов металлов), а также сложных эфиров и галогенопроизводных.
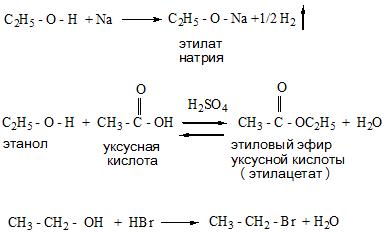
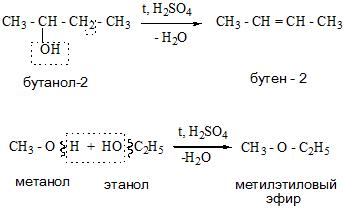
Реакции отщепления происходят по внутримолекулярному или межмолекулярному типу с отщеплением воды и получением алкенов и простых эфиров.
Во время реакций окисления спиртов образуются оксосоединения (альдегиды и кетоны).