Слайд 51Санкт-Петербургская олимпиада 2000 г. 9 классХимическое соединение, содержащее 92,83% элемента Х, поместили
в стакан и добавили 100 г раствора азотной кислоты. После окончания реакции остаток отфильтровали и получили чистый 12,00%-ный раствор нитрата Х. При добавлении 10 мл этого раствора к 100 мл раствора сульфата аммония выпадает осадок, в котором содержание Х на 24,5% меньше, чем в исходном веществе. При добавлении 10 мл этого раствора к 100 мл раствора аммиака выпадает осадок, в котором содержание Х только на 7% меньше, чем в исходном веществе.1. Предложите максимально простой, но обоснованный способ однозначного определения Х.2. Рассчитайте массовую долю HNO3 в растворе азотной кислоты.

Решение задач по химии
- Химические формулы
-
· Формула и валентность
· Вывод эмпирических формул
· Вывод молекулярных формул
· Расчёты при помощи моля
· Молярный объем газов
· Расчёты по молекулярным уравнениям
· Расчёты по термохимическим уравнениям
· Расчёты по массовым долям
· Электролитическая диссоциация
· Смещение химического равновесия - Справочный материал
-
· Периодическая таблица элементов
· Таблица степеней окисления
· Таблица растворимости солей
· Таблица электроотрицательности элементов
· Распределение электронов в атоме по энергетическим уровням
· Электронные конфигурации атомов по периодам
· Таблица названий кислот и их анионов
Простые вещества и их классификация
При изучении материала предыдущих параграфов, вы уже познакомились с некоторыми веществами. Так, например, молекула газа водорода, состоит из двух атомов химического элемента водорода –
Простые вещества – вещества, в состав которых входят атомы одного вида
К простым веществам, из числа известных вам веществ, относят: кислород, графит, серу, азот, все металлы: железо, медь, алюминий, золото и т.д. Сера состоит только из атомов химического элемента серы, а графит состоит из атомов химического элемента углерода. Нужно четко различать понятия «химический элемент» и «простое вещество».
Например, алмаз и углерод – не одно и тоже.
Углерод – химический элемент, а алмаз – простое вещество, образованное химическим элементов углеродом. В данном случае химический элемент (углерод) и простое вещество (алмаз) называются по-разному.
Часто химический элемент и отвечающее ему простое вещество называются одинаково. Например, элементу кислороду, соответствует простое вещество – кислород. Различать, где идет речь об элементе, а где о веществе, необходимо научиться! Например, когда говорят, что кислород входит в состав воды – речь идет об элементе кислороде. Когда говорят, что кислород – это газ, необходимый для дыхания – здесь идет речь о простом веществе кислороде. Простые вещества химических элементов подразделяют на две группы – металлы и неметаллы.
Металлы и неметаллы кардинально отличаются по своим физическим свойствам. Все металлы при нормальных условиях твердые вещества, исключение составляет ртуть – единственный жидкий металл.
Металлы непрозрачны, обладают характерным металлическим блеском. Металлы пластичны, хорошо проводят тепло и электрический ток.Неметаллы не похожи друг на друга по физическим свойствам. Так, водород, кислород, азот – газы, кремний, сера, фосфор – твердые вещества. Единственный жидкий неметалл – бром – жидкость коричнево-красного цвета.Если провести условную линию от химического элемента бора к химическому элементу астату, то в длинном варианте
Периодической Системы над линией расположены неметаллические элементы, а под ней – металлические. В коротком варианте Периодической Системы под этой линией расположены неметаллические элементы, а над ней – как металлические, так и неметаллические элементы. Значит, определять, является элемент металлическим или неметаллическим, удобнее по длинному варианту Периодической Системы.
Это деление условное, поскольку все элементы так или иначе проявляют как металлические, так и неметаллические свойства, но в большинстве случаев такое распределение соответствует действительности.
Химическая связь, строение и свойства вещества
Взаимодействия, результатом которых становится объединение химических частиц в вещества, принято делить на химические и межмолекулярные связи. Первая группа, в свою очередь, подразделяется на ионную, ковалентную и металлическую связи.
Ионная связь представляет собой связь разноименно заряженных ионов. Такая связь возникает за счет электростатического притяжения. Для того чтобы ионная связь образовалась, ионы должны быть разного размера. Это обусловлено тем, что ионы определенного размера склонны отдавать электроны, а другие – принимать их.
Ковалентная связь возникает за счет образования общей пары электронов. Для ее возникновения необходимо, чтобы радиус атомов был одинаковым или схожим.
Металлическая связь возникает за счет обобществления валентных электронов. Она образуется в случае, если размер атомов большой. Такие атомы обычно отдают электроны.
По типу строения все вещества можно разделить на молекулярные и немолекулярные. Большинство органических веществ относится к первому типу. По типу химической связи различают вещества с ковалентными, ионными и металлическими связями.
Массовая доля
Доля – одна часть чего-то целого. Например, пицца разрезана на восемь частей. Один кусок – 1/8 или 12,5 % от целой пиццы – это массовая доля.

Массовая доля обозначается буквой греческого алфавита («омега») ω и выражается в процентах (от 0 до 100) или цифрой от 0 до 1.
Массовая доля элемента
Массовая доля атома показывает, какая часть молекулярной массы соединения приходится на данный химический элемент.Ее рассчитывают по формуле:
где n – число атомов элемента в химическом соединении,
Ar(Э) – относительная атомная масса элемента,
Mr(в-ва) – относительная молекулярная масса соединения.
Задача. Найти массовую долю калия в перманганате калия KMnO4.
Найти относительную молекулярную массу соединения.
Mr(KMnO4) = 39 + 55 + 16 * 4 = 158 г/моль
Рассчитать массовую долю химического элемента в соединении.
ω (К) = 39г/моль /158 г/моль = 24,7 % или 0,247
Ответ: ω (К) = 24,7 % или 0,247
Массовая и объемная доля компонента смеси
Смесь – структура, образующаяся из двух и более веществ. Вещества, входящие в состав смеси, называют компонентами. Например, воздух – смесь азота, кислорода, углекислого газа и других. Если масса одного компонента в десятки раз меньше массы другого компонента смеси, то его называют примесью. Например, воздух может быть загрязнен угарным газом.
Массовая доля в жидких и твердых смесях рассчитывается по формуле:
Массовая доля в смеси газов (φ) рассчитывается по формуле:
Задача. В 10 мл дистиллированной воды растворили 1 г поваренной соли. Найдите массовую долю растворенного вещества.
Найти массу раствора.
m (р-ра) = m (H2O) + m (NaCl) = 10 г + 1 г = 11 г
Найти массовую долю соли.
ω (NaCl) = (1 г/11 г) * 100 % = 9,09 %
Ответ: ω (NaCl) = 9,09 %
Задача. В 4 л растворе содержится 100 г соляной кислоты HCl. Рассчитайте массовую долю растворенного вещества, учитывая, что плотность соляной кислоты – 1,098 г/мл.
Найти массу вещества.
m(р-ра) = V * p = 4000 мл * 1,098 г/мл = 4392 г
Найти массовую долю кислоты.
ω (НCl) = (100 г/4392 г) * 100 % = 2,277 %
Ответ: ω (НCl) = 2,277 %
Задача. К 700 г 48%-ного раствора добавили 30 г это же соли, которая находится в растворе. Определите массовую долю в полученной смеси?
Найти массу раствора.
m(р-ра) = 700 г + 30 г = 730 г
Найти массу растворенного вещества в исходном растворе.
m1(соли) = 700 г * 48 %/ 100 % = 336 г
Найти массу вещества в полученном растворе.
m2 (соли) = 336 г + 30 г = 366 г
Найти массовую долю соли в растворе.
ω (соли) = 366 г * 100 %/ 730 г = 50,137 %
Ответ: ω (соли) = 50,137 %
Задача. Смешали 200 г 35%-ного и 300 г 5%-ного раствора серной кислоты H2SO4. Определите массовую долю кислоты.
Найти массу первой кислоты.
m1 (соли) = 200 г * 35 % / 100 % = 70 г
Найти массу второй кислоты.
m1 (соли) = 300 г * 5 % / 100 % = 15 г
Найти массу раствора.
m (р-ра) = 200 г + 300 г = 500 г
Найти массу вещества.
m(в-ва) = 70 г + 15 г = 85 г
Найти массовую долю кислоты.
ω (к-ты) = 85 г * 100 % / 500 г = 17 %
Ответ: ω (к-ты) = 17 %
Массовая доля примесей
В природе практически во всех веществах есть примеси. Но в некоторых областях использование «грязных материалов» недопустимо. Например, в микросхеме компьютера используют только чистый кристалл кремния.
Вещество, содержащее примеси, называется образцом.Степень чистоты выражают массовой долей основного компонента, или массовой долей примесей.
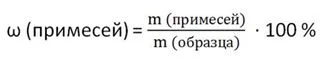
Задача. В самородной сере 8 % примесей. Сколько чистой серы в 500 кг природного образца?
Найти массу примесей в образце.
m(примесей) = 500 кг * 8 % / 100 % = 40 кг
Найти массу чистой серы в образце.
m(серы) = m(образца) – m (примесей) = 500 кг – 40 кг = 460 кг
Ответ: m (чистой серы) = 460 кг
Массовая доля продукта реакции
Большинство химических реакций обратимы. При необратимых реакциях часть веществ утрачивается, и выход продуктов уменьшается. Т.е. полученная практическая масса отличается от теоретической. В расчетах используют отношение реального количества получаемого вещества к теоретически вычисленному количеству. Это отношение называется выходом продукта химической реакции от теоретически возможного.
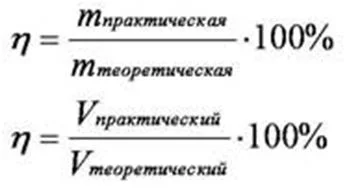
Задача. При взаимодействии хлора и метана (объем – 112 л) был получен дихлорметан, масса которого составила 255 г. Какова доля выхода дихлорметана.
Написать уравнение реакции.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
Рассчитать количества метана.
n(CH4) = V/Vm = 112 л/22,4л/моль = 5 моль
Посчитать теоретическое количество дихлорметана.
Исходя из уравнения: n(CH2Cl2) = n(CH4) = 5 моль
mтеор(CH2Cl2) = M *nтеор(CH2Cl2) = 85 г/моль * 5 моль = 425 г
Найти долю выхода дихлорметана.
η (CH2Cl2) = 255 г * 100 % / 425 г = 60%
Ответ: η (CH2Cl2) = 60%
Атом и молекула
Атом — это мельчайшая, химически неделимая частица вещества.
Молекула — это мельчайшая частица, сохраняющая в себе химические свойства и состав вещества.
В середине XVIII века русским учёным М.В. Ломоносовым и, спустя 50 лет, в 1803-ем году английским ученым Джоном Дальтоном была составлена первая таблица относительных атомных масс ряда химических элементов. Их идеи сыграли огромную роль в развитии атомно-молекулярного учения. Ими были выдвинуты более убедительные, веские идеи об образовании веществ из молекул и атомов, свойствах этих частиц.
Впервые термин «атом» был выдвинут Демокритом. Данное слово означает «неделимый».
По имени английского ученого Дальтона проблема, связанная со зрением,была названа дальтонизмом. В 1 794-ом году он описал эту болезнь, от которой страдал и сам ученый.
Древнегреческий философ Демокрит является одним из ученых-основоположников атомной теории.
В 1860-ом году была заложена основа «Атомно-молекулярного учения». Основными положениями атомно-молекулярного учения являются следующие:
Вещества состоят из молекул, а молекулы — из более мелких частиц — атомов (рис. 1).
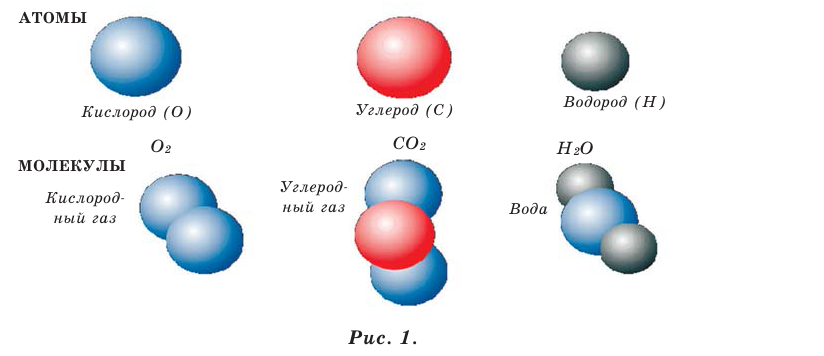
Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния и температуры вещества (рис. 2).
- Молекулы находятся в непрерывном движении, скорость движения молекул прямо пропорциональна температуре. То есть с повышением температуры увеличивается и скорость движения молекул.
- Между молекулами существуют силы взаимного притяжения и отталкивания.
- Молекулы состоят из атомов; атомы тоже, как и молекулы, находятся в непрерывном движении.
- Один вид атома отличается от другого вида атома своими массой и свойствами.
- При физических явлениях молекулы остаются в неизменном виде, однако при химических превращениях они распадаются, а атомы не распадаются.
Молекулы являются мельчайшими частицами многих веществ, их состав и химические свойства аналогичны самим веществам.
Самые большие вакуумы бывают между молекулами газа. Это объясняется их лёгкой сжимаемостью. Жидкости сжимаются с трудом. Между их молекулами расстояние сравнительно малое. Меньше всего расстояния между молекулами твёрдых веществ, вот почему они не сжимаются.
Только ли из молекул и атомов состоят вещества? Последующие научные поиски показали, что вещества могут состоять не только из молекул и атомов, являющихся незаряженными и нейтральными частицами, но также из положительно и отрицательно заряженных частиц — ионов. Например, поваренная соль, сода, известняк и др. являются такими веществами (более подробные сведения об этом вы получите в VIII классе). Вещества, состоящие из молекул, называются веществами молекулярного строения
(рис. 3 а), а из атомов и ионов — условно относят к веществам немолекулярного строения (рис. 3 б, в, г).
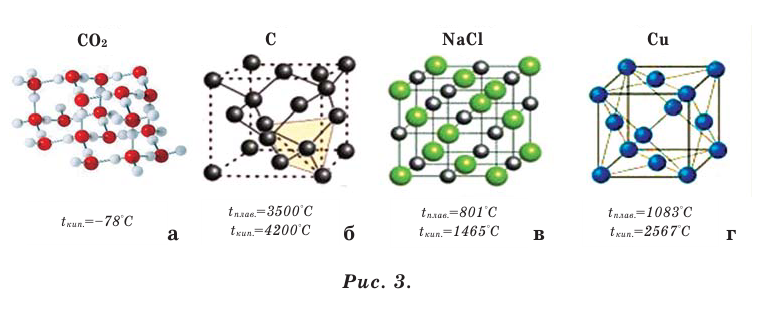
Вещества молекулярного и немолекулярного строения отличаются друг от друга по своим свойствам. Вещества молекулярного строения в обычных условиях — это газы (кислород, азот, водород, углекислый газ и др.) или жидкости (вода, спирт, ацетон и др.), а также легкоплавкие твёрдые вещества (кристаллическая сера, белый фосфор, сахар, иод и др.). Все же вещества немолекулярного строения — это тугоплавкие твёрдые вещества (алмаз, графит, песок, поваренная соль, сода и др.).
Массовая доля примесей
В задачах часто дается концентрация примесей в веществе или вещества в его минералах
Следует обратить внимание на то, что концентрация (массовая доля) чистого соединения будет определяться путем вычитания из 100% доли примеси
Например, если говорится, что из минерала получают железо, а процент примесей 80%, то чистого железа в минерале 100 — 80 = 20%.
Соответственно, если написано, что в минерале содержится только 20% железа, то во все химические реакции и в химическом производстве будут участвовать именно эти 20%.
Например, для реакции с соляной кислотой взяли 200 г природного минерала, в котором содержание цинка 5%. Для определения массы взятого цинка пользуемся той же формулой:
? = (m (в-ва) · m (р-ра)) / 100% ,
из которой находим неизвестную m раствора:
m (Zn) = ( w · 100% ) / m (минер.)
m (Zn) = (5 · 100) / 200 = 10 (г)
То есть, в 200 г взятого для реакции минерала содержится 5% цинка.
Задача. Образец медной руды массой 150 г содержит сульфид меди одновалентной и примеси, массовая доля которых составляет 15%. Вычислите массу сульфида меди в образце.
Решение задачи возможно двумя способами. Первый — это найти по известной концентрации массу примесей и вычесть ее из общей m образца руды. Второй способ — это найти массовую долю чистого сульфида и по ней уже рассчитать его массу. Решим обоими способами.
I способ
Вначале найдем m примесей в образце руды. Для этого воспользуемся уже известной формулой:
? = ( m (примесей) · m (образца)) / 100% ,
m(примес.) = (w · m (образца)) · 100% , (А)
m(примес.) = (15 · 150) / 100% = 22,5 (г).
Теперь по разности найдем количество сульфида в образце:
150 — 22,5 = 127,5 г
II способ
Вначале находим w соединения:
100 — 15 = 85%
А теперь по ней, воспользовавшись той же формулой, что и в первом способе (формула А), найдем m сульфида меди:
m(Cu2S) = (w · m (образца)) / 100% ,
m(Cu2S) = (85 · 150) / 100% = 127,5 (г).
Ответ: масса сульфида меди одновалентного в образце составляет 127,5 г.
Кто открыл закон
Авторство в отношении упомянутого закона принадлежит Жозефу Луи Прусту. Этот французский учёный, открывший закон в период с 1797 по 1809 гг., происходил из семьи аптекарей, увлекался исследованиями в области фармацевтики и химии.

Его опыты и разработки были интересны многим европейским университетам того времени, а с 1785 г. финансировались королём Испании. Пруст в результате своей деятельности значительно расширил имеющиеся сведения о ряде металлов и их солях.
Сам закон был выведен в результате многолетнего научного спора между Ж. Л. Прустом и его соотечественником К. Л. Бертолле, завершившегося в 1808 г. В ходе исследований свойств различных металлов учёный установил и смог доказать, что многие его современники допускали неточности при определении состава оксидов металлов, относя к этой группе гидроксиды.
Пруст сумел продемонстрировать, что различные оксиды одного и того же металла обладают определённым составом.
Однако, данный закон не носит всеобщий характер, в отличие от закона сохранения массы вещества, а справедлив исключительно для веществ с молекулярным строением. Вещества, имеющие немолекулярное строение, могут различаться по составу в зависимости от того, каким путём они получены.
Данный факт был установлен много позже русским физикохимиком Николаем Семёновичем Курнаковым, подтвердившим существование соединений переменного состава в ходе собственных исследований.
Дальнейшие эксперименты показали, что изменяемым химсоставом могут обладать оксиды и различные неорганические вещества с кристаллической структурой, в том числе соединения металлов с серой, углеродом, азотом.

Была создана классификация веществ, состав которых изменяем («бертоллидов») и соединений с постоянным химсоставом («дальтонидов»).
Количество веществ в изменяемых соединениях может колебаться в определённых установленных границах. Так, в диоксиде титана на единицу массы титана может приходиться от 0,65 до 0,67 единиц массы кислорода.
|
Дальтониды Примеры соединений |
Бертоллиды Примеры соединений |
||||
|
H2O |
H Cl |
C Cl4 |
CO2 |
Ti O1,9 – 2,0 |
V O0,9 –1,3 |
Открытие вышеупомянутого закона имело огромное значение для развития науки. Его следствием можно считать выдвижение постулата о существовании молекул и подтверждение неделимости атомов.
Решение
Так как при взаимодействии Ca(NO 3) 2 с водой идет только процесс растворения, а из раствора не выделяются продукты реакции, масса смеси равна сумме масс нитрата кальция и воды.
Нам нужно найти массовую долю кислорода в растворе
Обратим внимание на то, что кислород содержится как в растворенном веществе, так и в растворителе. Найдем количество искомого элемента в воде
Для этого посчитаем моль воды по формуле n=m/M.
n воды =500 г/(1*2+16) грамм/моль=27.7777≈28 моль
Из формулы воды H 2 O найдем, что количество кислорода = количеству воды, то есть 28 моль.
Теперь найдем количество кислорода в растворенном Ca(NO 3) 2 . Для этого узнаем количество самого вещества:
n Ca(NO3)2 =34 г/(40*1+2*(14+16*3)) грамм/моль≈0.2 моль.
n Ca(NO3)2 относится к n O как 1 к 6, что следует из формулы соединения. Значит, n O = 0.2 моль*6 = 1.2 моль. Суммарно количество кислорода равно 1.2 моль+28 моль=29.2 моль
m O = 29.2 моль*16 грамм/моль=467.2 г.
m раствора =m воды + m Ca(NO3) 2= 500 г+34 г=534 г.
Осталось только само вычисление массовой доли химического элемента в веществе:
w O =467.2 г /534 г≈0.87=87%.
Ответ: 87%.
Надеемся, что мы понятно объяснили вам то, как находить массовую долю элемента в веществе. Данная тема вовсе не сложная, если в ней хорошо разобраться. Желаем вам удачи и успехов в будущих начинаниях.
Что же такое массовая доля? Например, массовая доля химического элемента — это отношении массы элемента к массе всего вещества
. Массовая доля может выражаться как в процентах, так и долях.
Где же может применятся массовая доля?
Вот одни из направлений:
Определение элементарного состава сложного химического вещества
Нахождение массы элемента по массе сложного вещества
Для расчетов используется калькулятор Молярная масса вещества онлайн с расширенными данными которые можно увидеть если пользоватся XMPP запросом.
Расчет подобных задач, что указаны выше, при примении этой страницы становятся еще проще, удобнее и точнее. Кстати про точность. В школьных учебниках почему то молярные массы элементов округлены до целых значений, что для решения школьных задач это вполне пригодится, хотя на самом деле молярные массы каждого химического элемента периодически предаются корректировке.
Наш калькулятор не стремится показать высокую точность (выше 5-ти знаков после запятой), хотя в этом нет ничего сложного. В большинстве своем, те атомные массы элементов, которые используют калькулятор, достаточны для решения поставленных задач на определение массовых долей элементов
Но для тех педантов:) , которым важна точность, хотелось бы порекомендовать ссылку Atomic Weights and Isotopic Compositions for All Element s
в которой отображены все химические элементы, их относительные атомные массы, а также массы всех изотопов каждого из элемента.
Вот и все, что хотелось бы сказать. Теперь будем рассматривать конкретные задачи и как их решать. Заметьте что несмотря на то, что они все разнородны, они в своей сути опираются на молярную массу вещества и массовые доли элементов в этом веществе
На начало осени 2017 года, я добавил еще один калькульятор Мольные доли вещества и количество атомов , который поможет решать задачи на массу чистого вещества в сложном веществе, количество моль в веществе и в каждом элементе, а также количество атомов/молекул в веществе.
Химическое строение органических веществ
Как известно, в составе органических веществ всегда присутствует углерод. Этим органические вещества отличаются от неорганических. Органические вещества используются в быту, они служат сырьевой базой для производства продуктов питания и различных продовольственных товаров.
Ученым удалось синтезировать множество видов органических веществ, которых нет в природе (различные виды пластмасс, каучук и другие). Органические вещества отличаются от неорганических своим химическим строением.
Атомы углерода образуют различные цепи и кольца. Этим объясняется огромное разнообразие органических веществ в природе.
Атомные связи в таких веществах имеют ярко выраженный ковалентный характер. При нагревании органические вещества полностью разлагаются. Это объясняется небольшой прочностью межатомных связей.
Среди органических соединений широко распространено такое явление, как изомерия.
Расчет по химическим формулам
Решим несколько обратных задач.
Для того, чтобы найти относительную молекулярную массу вещества, необходимо сложить все произведения относительных атомных масс элементов, входящих в это вещество, на их стехиометрические индексы.
Пример 4. Найти относительную молекулярную массу и отношение масс элементов в сульфате натрия Na2SO4.
Решение.
Ar(Na)=23; Ar(S)=32; Ar(O)=16 Mr(Na2SO4)=Ar(Na)·2+Ar(S)+Ar(O)·4 Mr(Na2SO4)=23·2+32+16·4=142 Относительная молекулярная масса: Mr(Na2SO4)=142 г/моль Отношение масс натрия, серы и кислорода: Na:S:O = 46:32:64 = 23:16:32
Пример 5. Найти массовые доли элементов в NaOH.
Решение.
Ar(Na)=23; Ar(O)=16; Ar(H)=1 Mr(NaOH)=23+16+1=40 г/моль Массовая доля натрия: W(Na)=Ar(Na)/Mr(NaOH) = 23/40 = 57,5% Массовая доля кислорода: W(O)=16/40=40% Массовая доля водорода: W(H)=1/40=2,5%
Решение задач с неизвестным элементом в соединении
Задача. Определите название элемента (Э) в соединении Э2О3, при том, что его массовая доля составляет 68,42%.
Найти молярную массу.
М (Э2О3) = 2 * х + 3 * 16 = 2х + 48
Найти массовую долю элемента в химическом соединении.
Пусть О(Э2О3) = 1 моль
ω (Э) =m (Э) / m (Э2О3) =2х / (2х + 48) = 0,684
Найти атомную массу элемента.
0,684 (2х +48) / 0,684 = 2х / 0,684
2х + 48 = 2,924х
х = 52
Определить химический элемент.
М (Cr) = 52 г/моль
Ответ: Cr2O3
Задача. Оксид пятивалентного элемента содержит 56,34% кислорода. Какой состав вещества?
Определить формулу соединения.
Т.к. элемент имеет валентность равную V, то оксид выглядит следующим образом Э2О5
Вычислить молярную массу элемента.
ω (О) = m (О) / m (Э2О5) = (5 * 16) / (2х + 5 * 16) = 0,684
1,1268х + 45,072 = 80
1,1268х = 34,928
х = 31
Определить по атомной массе химический элемент.
М (Р) = 31 г/моль
Ответ: Р2О5
Уточненная формулировка закона постоянства вещества
Для многих бертоллидов существуют границы, в пределах которых может изменяться их состав. Например,
оксид урана (IV) имеет состав от UO2,5 до UO3, оксид ванадия (II) – от VO0,9 до VO1,3.
Таким образом, имеет смысл внести уточнения в существующую формулировку закона постоянства состава:
Состав соединений молекулярной структуры, т.е. состоящих из молекул, является постоянным независимо от способа получения. Если состав соединений имеет немолекулярную структуру ( а, например, атомную, ионную), то он не является постоянным и зависит от условий получения.
Что мы узнали?
В учебнике химии 8 класса кратко раскрывается определение закона постоянства состава вещества, дается его четкая формулировка, а также рассматриваются соединения переменного и постоянного состава. В данной теме раскрываются все эти аспекты, а также дается определение дальтонидам и бертоллидам.
-
/10
Вопрос 1 из 10































