Строение атома[править]
- Основная статья: Строение атома
А́томw — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Атом состоит из ядра и атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом.
Ионw — одноатомная или многоатомная электрически заряженная частица, образующаяся в результате потери или присоединения атомом или молекулой одного или нескольких электронов.
Ядроw состоит из положительно заряженных протонов и нейтральных нейтронов.
Прото́нw (от др.-греч. πρῶτος — первый, основной) — элементарная частица, электрический заряд +1.
Нейтронw — элементарная частица, не имеющая электрического заряда.
Электронw — стабильная, отрицательно заряженная элементарная частица, одна из основных структурных единиц вещества.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулыw.
А́томная ма́ссаw, относительная атомная масса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопаw углерода 12Cw, поэтому атомная масса этого изотопа по определению равна точно 12. Разность между атомной массой изотопа и его массовым числомw называется дефектом массыw (обычно выражаемом в МэВw). Он может быть как положительным, так и отрицательным; причина его возникновения — нелинейная зависимость энергии связи ядер от числа протонов и нейтронов, а также различие в массах протона и нейтрона.
Химический элемент и его свойства
В 1869 г. Д.И. Менделеев сформулировал периодический закон, современная формулировка которого звучит следующим образом:
Свойства химических элементов находятся в периодической зависимости от заряда ядра атомов химических элементов.
До того, как начать разговор о Периодической системе, давайте разберемся с тем, что же такое собственно химический элемент.
Химический элемент — совокупность (группа, сорт, вид) атомов, обладающих одинаковыми свойствами, с одним и тем же количеством протонов и нейтронов в ядре, электронов в электронной оболочке.
Свойства элементов можно распределить по нескольким группам:
- металлические/неметаллические свойства,
- окислительно-восстановительные свойства,
- радиус атома,
- электроотрицательность,
- валентность и степени окисления,
- энергия ионизации,
- энергия сродства к электрону.
Данные свойства во многом зависят от положения атома в таблице Менделеева и атома. Подробнее о влияние конфигурации на свойства атома можно прочитать в статье «Строение атомов и электронные конфигурации».
Также практически все химические элементы, в отличие от веществ:
- Могут образовывать ионы.
- Содержатся в различных органических и неорганических веществах.
- Могут образовывать аллотропные модификации (аллотропия — способность химического элемента образовывать несколько простых веществ). Например, атом кислорода может быть в виде соединения кислорода О2 и озона О3.
- Имеют изотопы — разновидности атомов химического элемента, имеющие одинаковое количество протонов и электронов, но разное количество нейтронов, следовательно, и разную атомную массу.
| Как «вес» элемента может сказаться на его «работе»?Мы упомянули, что изотопы имеют различную массу. Оказывается, «вес» элемента напрямую влияет на его свойства и применение.Самыми известными являются изотопы водорода: водород (масса равна 1), дейтерий (масса равна 2) и тритий (масса равна 3). Более тяжелые изотопы используются в атомной энергетике, для осуществления термоядерного синтеза и для создания водородных бомб.Изотопы имеет и углерод: углерод-12, углерод-13 и углерод-14 (цифра обозначает массу атома). Если первые два стабильны и встречаются повсеместно, то последний за счет своей массы менее стабилен — он хочет быстрее сбросить с себя лишние нейтроны путем распада. Данное качество сыграло решающую роль в применении углерода-14. Ученые рассчитали «время жизни» изотопа, благодаря чему при анализе органических веществ по количеству найденного углерода-14 можно сделать вывод о возрасте найденного объекта. Данный метод был назван радиоуглеродным анализом, сейчас он находит широкое применение при датировке (определении возраста) ископаемых. За это открытие в 1960 году Уилларду Либби была присуждена Нобелевская премия по химии. |

Теперь, когда мы разобрались в понятии и общих свойствах химических элементов, давайте разберем подробнее, как именно зависят их свойства от местонахождения в Периодической системе.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
 Д. И. Менделеев (1834-1907)
Д. И. Менделеев (1834-1907)
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
 Первоначальный вариант таблицы Менделеева
Первоначальный вариант таблицы Менделеева
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Группы
Вертикальные столбики элементов в периодической таблице — группы состоят из подгрупп: главной и побочной, они иногда обозначаются буквами А и Б соответственно.
В состав главных подгрупп входят s- и р-элементы, а в состав побочных — d- и f-элементы больших периодов.
Главная подгруппа — это совокупность элементов, которая размещается в периодической таблице вертикально и имеет одинаковую конфигурацию внешнего электронного слоя в атомах.
Как следует из приведенного определения, положения элемента в главной подгруппе определяется общим количеством электронов (s- и р-) внешнего энергетического уровня, равным номеру группы. Например, сера (S — 3s2 3p4 ), в атоме которого на внешнем уровне содержится шесть электронов, относится к главной подгруппе шестой группы, аргон (Ar — 3s2 3p6 ) — к главной подгруппе восьмой группы, а стронций (Sr — 5s2 ) — к ІІА-подгруппе.
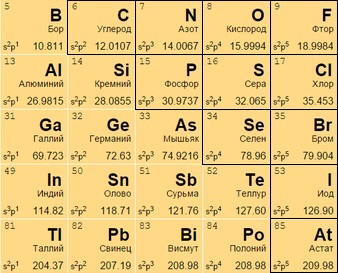
Элементы одной подгруппы характеризуются сходством химических свойств. В качестве примера рассмотрим элементы ІА и VІІА подгрупп (табл.2). С ростом заряда ядра увеличивается количество электронных слоев и радиус атома, но количество электронов на внешнем энергетическом уровне остается постоянной: для щелочных металлов (подгруппа IА) — один, а для галогенов (подгруппа VIIА) — семь. Поскольку именно внешние электроны наиболее существенно влияют на химические свойства, то понятно, что каждая из рассмотренных групп элементов-аналогов имеет подобные свойства.
Но в пределах одной подгруппы наряду с подобием свойств наблюдается их некоторое изменение. Так, элементы подгруппы ІА все, кроме Н — активные металлы. Но с ростом радиуса атома и количества электронных слоев экранирующих влияние ядра на валентные электроны, металлические свойства усиливаются. Поэтому Fr более активный металл, чем Сs, a Cs — более активный, чем R в и т.д. А в подгруппе VIIA по той же причине ослабляются неметаллические свойства элементов при росте порядкового номера. Поэтому F — более активный неметалл по сравнению с Cl, a Cl — более активный неметалл сравнению с Br и т.д.
Таблица 2 — Некоторые характеристики элементов ІА и VІІА-подгрупп
| период | Подгруппа IA | Подгруппа VIIA | ||||||
|---|---|---|---|---|---|---|---|---|
| Символ элемента | Заряд ядра | Радиус атома, нм | Внешняя электронная конфигурацiя | Символ элемента | Заряд ядра | Радиус атома, нм | Внешняя электронная конфигурацiя | |
| II | Li | +3 | 0,155 | 2 s 1 | F | +9 | 0,064 | 2 s 2 2 p 5 |
| III | Na | +11 | 0,189 | 3 s 1 | Cl | +17 | 0,099 | 3 s 2 3 p 5 |
| IV | K | +19 | 0,236 | 4 s 1 | Br | 35 | 0,114 | 4 s 2 4 p 5 |
| V | Rb | +37 | 0,248 | 5 s 1 | I | +53 | 0,133 | 5 s 2 5 p 5 |
| VI | Cs | 55 | 0,268 | 6 s 1 | At | 85 | 0,140 | 6 s 2 6 p 5 |
| VII | Fr | +87 | 0,280 | 7 s 1 | — | — | — | — |
Побочные подгруппа — это совокупность элементов, размещаемых в периодической таблице вертикально и имеют одинаковое количество валентных электронов за счет застройки внешнего s- и втором снаружи d-энергетических подуровней.
Все элементы побочных подгрупп относятся к d-семейству. Эти элементы иногда называют переходными металлами. В побочных подгруппах свойства изменяются более медленно, поскольку в атомах d-элементов электроны застраивают второй извне энергетический уровень, а на внешнем уровне находятся только один или два электрона.
Положение первых пяти d-элементов (подгруппы IIIБ- VIIБ) каждого периода можно определить с помощью суммы внешних s-электронов и d-электронов второго снаружи уровня. Например, из электронной формулы скандия (Sc — 4s2 3d1 ) видно, что он размещается в побочной подгруппе (поскольку является d-элементом) третьей группы (поскольку сумма валентных электронов равна трем), а марганец (Mn — 4s2 3d5 ) размещается в побочной подгруппе седьмой группы.
Положение последних двух элементов каждого периода (подгруппы IБ и IIБ) можно определить по количеству электронов на внешнем уровне, поскольку в атомах этих элементов предыдущий уровень является полностью завершенным. Например, Ag ( 5s1 5d10 ) размещается в побочной подгруппе первой группы, Zn ( 4s2 3d10 ) — в побочной подгруппе второй группы.
Триады Fe-Co-Ni, Ru-Rh-Pd и Os-Ir-Pt размещены в побочной подгруппе восьмой группы. Эти триады образуют две семьи: железа и платиноидов. Кроме указанных семей отдельно выделяют семью лантаноидов (четырнадцать 4f-элементов) и семью актиноидов (четырнадцать 5f-элементов). Эти семьи принадлежат к побочной подгруппе третьей группы.
Рост металлических свойств элементов в подгруппах сверху вниз, а также уменьшение этих свойств в пределах одного периода слева направо обусловливают появление в периодической системе диагональной закономерности. Так, Be очень похож на Al, B — на Si, Ti — на Nb. Это ярко проявляется в том, что в природе эти элементы образуют подобные минералы. Например, в природе Те всегда бывает с Nb, образуя минералы — титанониобаты.
Как изменяются свойства элементов в Периодической таблице
Свойства элемента иногда классифицируются либо как химические, либо как физические. Химические свойства обычно наблюдаются в ходе химической реакции, в то время как физические свойства наблюдаются при исследовании образца чистого элемента. Химические свойства элемента обусловлены распределением электронов вокруг ядра атома, особенно внешних, или валентных, электронов; именно эти электроны участвуют в химических реакциях. Химическая реакция не влияет на атомное ядро; поэтому атомный номер остается неизменным в химической реакции.
Некоторые свойства элемента можно наблюдать только в совокупности атомов или молекул этого элемента. Эти свойства включают цвет, плотность, температуру плавления, температуру кипения, а также тепловую и электрическую проводимость. В то время как некоторые из этих свойств обусловлены главным образом электронной структурой элемента, другие более тесно связаны со свойствами ядра, например, массовым числом.
Примечание 2
Элементы иногда группируются в соответствии с их свойствами. Одна из основных классификаций элементов — металлы, неметаллы и металлоиды. Элементы с очень похожими химическими свойствами часто называют семействами; некоторые семейства элементов включают галогены, инертные газы и щелочные металлы. В периодической таблице элементы расположены в порядке возрастания атомного веса таким образом, что элементы в любом столбце обладают схожими свойствами.
Тенденции периодической таблицы
Понимание периодического изменения энергии ионизации, сродства к электрону, электроотрицательности, свойств кислот и оснований, числа окисления в окислительно-восстановительной реакции химических элементов являются очень важными характеристиками для любого обсуждения или информации в химии или науке. При изучении химии мы суммируем физические и химические свойства по группам и периодам.
Когда мы двигаемся вниз в группе, размер и электроположительный характер атомов увеличиваются. Энергия ионизации обычно уменьшается, но во многих случаях увеличивается из-за экранирования электронов или эффективных ядерных зарядов. У нижнего элемента кристаллических твердых металлов, таких как серебро (Ag), золото (Au), кадмий (Cd) и ртуть (Hg), энергия ионизации увеличивается. Электроотрицательность и сродство к электрону обычно уменьшаются, но иногда наблюдаются некоторые исключения. Тенденция сродства к электрону химического элемента второго ряда периодической таблицы обычно ниже, чем у третьего ряда.
Периодическая таблица с электронной конфигурацией
Пара элементов расположена по диагонали друг к другу в таблице периодов, чтобы описать простое соотношение или химические свойства, такие как электрическая поляризация содержимого в химии. Диагональная пара, такая как бериллий и алюминий, имеет аналогичное соотношение изменения / размера, поскольку размер увеличивается с меньшим периодом, в то время как заряд увеличивается вправо, но это правило не может работать полностью для всех элементов периодической таблицы.
Интересные факты в периодической таблице Менделеева, объясняющие общую связь между электронной структурой и периодическим размещением, предназначением химических элементов в краткой форме. Например, орбиталь 1s может иметь только два электрона, следовательно, период один содержит только два элемента. Период-VI включает 6s, 4f, 5d и 6p орбитали в электронной структуре валентной оболочки с общим количеством (2 + 14 + 10 + 6) = 32 элемента от цезия до радона. Упрощенная научная формула в химии используется для вычисления количества химических элементов в каждом периоде семейств периодической таблицы Менделеева.
Элементы таблицы Менделеева

Также есть класс «металлоподобных» полупроводников с неопределенным статусом. Отдельно располагаются благородные газы, не подверженные реакциям.
Часть элементов с номером более 100 открыта сравнительно недавно, их принадлежность к каким-либо группам только предположительна.
Щелочные и щелочноземельные элементы
Представители 1 (IA) и 2 (IIA) групп таблицы Менделеева — металлы со слабой устойчивостью и высокой степенью растворимости:
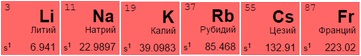
Щелочные металлы имеют серебристый отблеск, хорошо разламываются и режутся. Из всех размещенных в таблице металлов активнее других вступают в реакцию с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой создают гидроксиды – щелочи:
2Na + 2H20 = 2NaOH + H2
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком. В их список входят:

Большая часть из них способна создавать щелочь, но не так легко расстается с двумя незанятыми электронами. Другие металлы они замещают, но перед щелочными бессильны и вытесняются ими из молекул.
Лантаноиды и актиноиды
Прежде получили название редкоземельных металлов из-за малого количества месторождений и трудностей в выводе чистого металла из соединений. Им соответствует 3 (III B) группа, хотя это иногда оспаривается.

В рамках семейства лантаноиды («скрытые») имеют схожую форму атома и внешние признаки, но различаются свойствами. Поодиночке почти не встречаются.
Актиноиды, помимо общих черт, радиоактивны. В природе, кроме, урана U 92, почти не встречаются, создаются искусственно.

Для удобства обе группы элементов выведены в 2 строки под общей таблицей.
Галогены и благородные газы
17 (VII A) группа состоит из галогенов:

В противоположность щелочам, эти неметаллы – самые сильные окислители, активно принимающие 8-й электрон к имеющимся семи для заполнения внешней оболочки.
Самый реактивный – фтор F 9 (способен разрушать молекулы воды):
2F2
+ 2H2O = 4HF + O2
3F2
+ 3H2O = OF2 + 4HF + H2O2
С ростом периода свойства элементов слабеют.
Все галогены токсичны, опасны для жизни, поражают дыхательные пути.
В последней, VIII A или 18 группе, находятся инертные газы:

Их внешний уровень электронов равен 8 (полностью заполнен), отчего они не способны вступать в реакцию с другими атомами. Крайне редко создают непрочные молекулы, распадающиеся при нагревании.
Переходные металлы
Представлены всеми подгруппами в традиционной системе или занимают с 3 по 12 столбцы в современных таблицах. Большинство обладает металлическим блеском, по цвету и состоянию различаются (большинство – твердые, но есть исключения, например, жидкая ртуть).
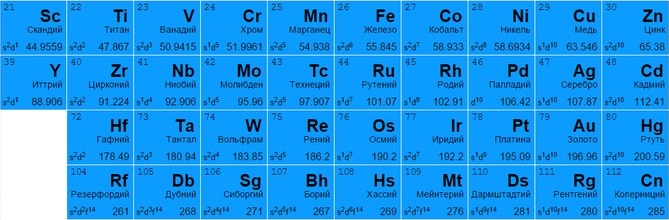
Могут отдавать разное количество электронов с нескольких оболочек для создания вещества (например, титан Ti 22 и железо Fe 26 способны отдавать от 2 до 4, медь Cu 29 – от 1 до 2, цинк Zn 30 – только 2, золото Au 79 и серебро Ag 47 практически не вступают в реакцию).
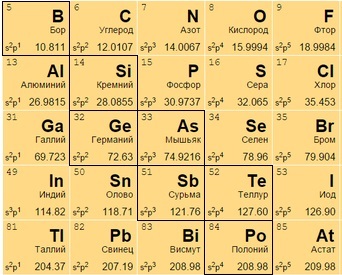
Металлоиды
Располагаются на стыке посреди легких металлов и неметаллов, в диагонали с 13 по 17 группах. В своем большинстве – полупроводники (хуже металлов проводят электрический ток).
Часть из них – металлы внешне, неметаллы по активности, часть – наоборот. Бор B 5, к примеру, является неметаллом с полупроводниковыми качествами.
Постпереходные металлы
Они же «легкие». От переходных аналогов отличаются меньшей твердостью и весом. Имеют иные температуры плавления и кипения. Для соединений отдают электроны только с внешней оболочки. Превосходят полуметаллы по восстановительности. Легкий металл выглядит как вещество с матовым оттенком вместо блеска.
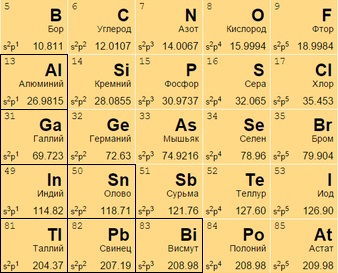
Размещаются после переходных металлов под полупроводниками (в 13-17 столбцах или IIIA – VIIA). Алюминий Al 13 носит неопределенный статус (иногда причисляется к металлоидам).
Неметаллы
Располагаются в правом верхнем углу между полуметаллами и инертными газами (начала 13-17 групп). Имеют больше электронов на внешней оболочке, стремятся присоединить к себе еще больше (в противоположность металлам), чтобы набрать полный уровень электронов.
Могут находиться:
-
в виде газа (кислород O 8, азот N 7);
-
жидкости (бром Br 35);
-
в твердом (углерод C 6, кремний Si 14) состоянии.
Интересное положение занимает водород H 1. Его причисляют то к 1, то к 17 группе: он, будучи неметаллом, может проявлять и окислительные, и восстановительные свойства.
Значение для мировой науки
В начале восьмидесятых годов из Германии поступали сообщения о новых, искусственно созданных химических веществах. К 1996 году полдюжины новых элементов были созданы в институте по исследованию тяжёлых ионов в немецком городе Дармштадте.
Значение таблицы Д. Менделеева для мировой науки:

- она явилась наиболее важным этапом в развитии атомно-молекулярного учения;
- с её помощью стало возможным предсказание ранее неизвестных химических элементов;
- частицы, обнаруженные позже, точно стали на свободные места таблицы, предсказанные Менделеевым;
- таблица помогла составить понятие о химическом элементе в современном понимании;
- таблица дала возможность систематизировать типы атомов, для вновь созданных разделов физики (атомной физики и физики ядра).
Вначале периодическую систему пополняли новыми частицами химики, а сейчас эту задачу выполняют физики. Периодическая система элементов, созданная Дмитрием Менделеевым больше века назад, оказалось настолько универсальной, что каждое новое открытие только подтверждает ее верность.
Валентные элементы в группах
Нетрудно заметить, что внутри каждой группы элементы похожи друг на друга своими валентными электронами (электроны s и p-орбиталей, расположенных на внешнем энергетическом уровне).
У щелочных металлов — по 1 валентному электрону:
- Li — 1s22s1;
- Na — 1s22s22p63s1;
- K — 1s22s22p63s23p64s1
У щелочноземельных металлов — по 2 валентных электрона:
- Be — 1s22s2;
- Mg — 1s22s22p63s2;
- Ca — 1s22s22p63s23p64s2
У галогенов — по 7 валентных электронов:
- F — 1s22s22p5;
- Cl — 1s22s22p63s23p5;
- Br — 1s22s22p63s23p64s23d104p5
У инертных газов — по 8 валентных электронов:
- Ne — 1s22s22p6;
- Ar — 1s22s22p63s23p6;
- Kr — 1s22s22p63s23p64s23d104p6
| Римский номер столбца группы — это количество валентных электронов у всех элементов данной группы. |
Дополнительную информацию см. в статье Валентность и в Таблице электронных конфигураций атомов химических элементов по периодам.
Обратим теперь свое внимание на элементы, расположенные в группах с символов В. Они расположены в центре периодической таблицы и называются переходными металлами
Отличительной особенностью этих элементов является присутствие в атомах электронов, заполняющих d-орбитали:
- Sc — 1s22s22p63s23p64s23d1;
- Ti — 1s22s22p63s23p64s23d2
Отдельно от основной таблицы расположены лантаноиды и актиноиды — это, так называемые, внутренние переходные металлы. В атомах этих элементов электроны заполняют f-орбитали:
- Ce — 1s22s22p63s23p64s23d104p64d105s25p64f15d16s2;
- Th — 1s22s22p63s23p64s23d104p64d105s25p64f145d106s26p66d27s2
Подробнее см. Атомы переходных элементов (металлов)…
Как понять таблицу Менделеева, если ты не шаришь?
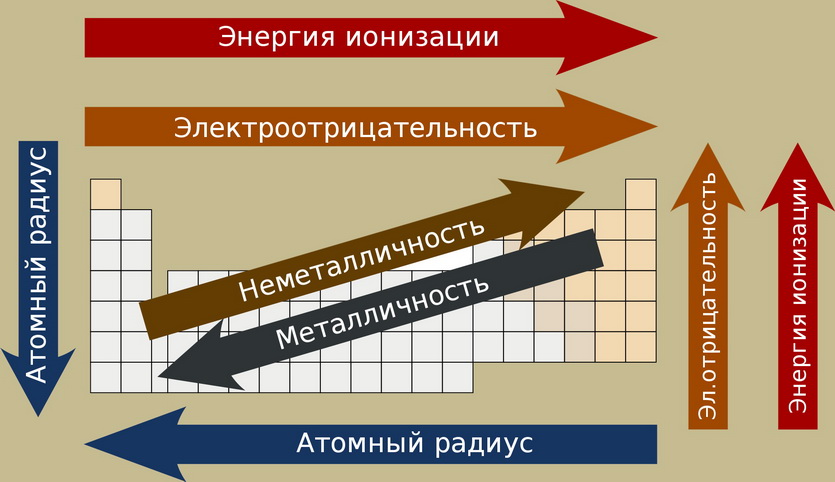 Краткая шпаргалка к Таблице Менделеева
Краткая шпаргалка к Таблице Менделеева
Периодический закон легко применять на практике. Ещё со школы мы все должны знать: натрий похож на калий, фтор похож на хлор, а золото — на серебро и медь. Следующий элемент просто как бы прибавляет к уже существующим ещё что-то.
По самой таблице так же можно узнать примерные свойства. В подгруппах сверху вниз:
️ усиливаются металлические свойства и ослабевают неметаллические (появляются свободные электроны — проводит ток);
️ возрастает атомный радиус (выше плотность/масса),
️ возрастает сила образованных элементом оснований и бескислородных кислот (действие сильнее),
️ электроотрицательность падает (хуже соединяется с другими элементами).
В периоде с увеличением порядкового номера элемента:
️ электроотрицательность возрастает (лучше образовывает соединения),
️ металлические свойства убывают, неметаллические возрастают (хуже проводит ток),
️ атомный радиус падает (хуже создает соединения).
Ещё одно свойство связано с традиционной, «короткой» формой таблицы, предложенной самим Менделеевым: если сложить её пополам, посредине IV группы, окажется, что элементы напротив друг друга могут образовывать соединения друг с другом.
Хотя на первый взгляд это не нужно в обыденности, таблица Менделеева помогает быстро понять, например: какая кислота «сильнее», что лучше проводит ток, к чему не стоит прикасаться, чем можно отравиться.
Таблица Менделеева с выделением главных и побочных подгрупп
Элементы главных подгрупп обозначены фиолетовым цветом, побочных — серым. Я напоминаю, что свойства элементов, находящихся в одной группе, но в разных подгруппах, отличаются достаточно сильно.
Например, натрий, калий, медь и серебро находятся в I группе: Na и K — в главной подгруппе, Cu и Ag — в побочной. Свойства натрия и калия весьма похожи — активные металлы, бурно реагирующие с водой, легко окисляющиеся на воздухе, имеют низкие температуры плавления и кипения. Все это сильно отличается от свойств меди и серебра: инертные металлы, которые не реагируют не только с водой, но и с большинством кислот, на воздухе устойчивы, температуры плавления и кипения достаточно высоки.
Еще ярче отличия заметны, например, в VI группе. Кислород, сера, селен (главная подгруппа) — типичные неметаллы, а хром, молибден и вольфрам, находящиеся в побочной подгруппе, относятся к металлам.
Все проблемы исчезают, если вы используете таблицы Менделеева: «мешанина» из элементов главных и побочных подгрупп исчезает, и мы начинаем отчетливо видеть логику периодического закона.
| Периоды | Группы элементов | |||||||||
| I | II | III | IV | V | VI | VII | VIII | |||
| 1 |
1 |
1 |
2 |
|||||||
| 2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||
| 3 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
||
| 4 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
|
29 |
30 |
31 |
32 |
33 |
34 |
35 |
36 |
|||
| 5 |
37 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
|
47 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
|||
| 6 |
55 |
56 |
57 |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
|
79 |
80 |
81 |
82 |
83 |
84 |
85 |
86 |
|||
| 7 |
87 |
88 |
89 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
| Высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | ||
| Водородные соед. | RH4 | RH3 | H2R | HR |
| *Лантаноиды |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
| ^Актиноиды |
90 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 |
Знаки химических элементов
Химические элементы в Периодической системе обозначаются химическими знаками или символами.
Шведский химик Й. Берцелиус предложил в качестве символа для каждого элемента записывать начальные буквы латинского названия химического элемента.
{"questions":,"answer":0}}},{"content":"Кто предложил записывать знаки химических элементов начальными буквами их латинских названий?`choice-6`","widgets":{"choice-6":{"type":"choice","options":,"explanations":,"answer":}}}]}
Названия некоторых химических элементов отражают их важные свойства. К примеру, кислород – рождающий кислоты, водород – рождающий воду и т. д.
Другие названия заимствованы из мифологии, как тантал.
Это имя одного из сыновей Зевса. Он совершил преступление перед богами и был наказан: стоял по горло в воде, а над его головой свисали ветви с ароматными плодами. Но как только он хотел напиться или поесть, ветви отклонялись в сторону, а вода утекала.
Выделяя тантал из руд, химики также испытали немало мучений.
Отдельные элементы названы в честь планет Солнечной системы или различных небесных тел: плутоний, уран, селен (с греч. Селена – Луна).
Некоторые названы в честь стран, городов или частей света: европий, германий, скандий, берклий, дубний, америций.
Также в названиях элементов воспеты имена величайших исследователей: эйнштейний, кюрий, менделеевий.
Альберт Эйнштейн во время чтения лекции (Вена, 1921)
{"questions":,"items":}}}]}
ФАКТЫ
История открытия химического элемента $Na$ (натрия)
Натрий и его соединения известны с давних времен. Еврейское слово neter встречается в Библии как название вещества, которое вскипает с уксусом.
Сода (натрон), встречается в природе в водах натронных озер в Египте.
Древние египтяне использовали природную соду для отбеливания холста, варки пищи, бальзамирования, изготовления глазурей и красок.
Как писал Плиний Старший, в дельте Нила соду выделяли из речной воды.
Она продавалась в виде больших кусков, а из-за примесей угля была окрашена в серый или черный цвет.
Название «натрий» произошло от латинского слова natrium, которое заимствовали из среднеегипетского языка, где оно означало: «сода», «едкий натр».
Аббревиатура «$Na$» и слово natrium были впервые использованы Йенсом Якобсом Берцелиусом для обозначения природных минеральных солей, в состав которых входила сода.
Английский химик Хемфри Дэви в 1807 году впервые получил натрий электролизом расплава гидроксида натрия.


























