Классификация по результатам реакции
Присоединение
Присоединение характерно для непредельных органическихсоединений. В таких реакциях тройная связь превращается в двойную, а двойная в ординарную:
В реакциях присоединения ΔS отрицательно, так как возможности (степени свободы) трансляции уменьшаются. Величина ΔН также отрицательна. Реакции идут при умеренных температурах.
Реакции отщепления (элиминирования)
Элиминирование (отщепление) — процесс, обратный присоединению, в результате которого отщепляются простые или сложные вещества:
Очевидно, что ΔS положительно. Такие реакции возможны при достаточно высоких температурах, а отщепляются обычно термодинамически стабильные частицы (Н2O , СО, СO2 и др.).
Реакции замещения
Замещение. В реакциях этого типа атом или группа атомов в соединении замещаются на другой атом или группу атомов:
СН4 + Сl2 → СН3Сl + НСlСН3СН2Сl + Н2O → СН3СН2ОН + НСl
Реакции, в которых одним из реагентов является растворитель, называют сольволизом (гидролиз, алкоголиз, аммонолиз — соответственно вода, спирт, аммиак). Если в результате реакции замещения отщепляются вода, спирт, аммиак, то говорят о реакции конденсации:
Общее число частиц в реакциях замещения не изменяется, то есть ΔS ≈ 0.
Перегруппировка, изомеризация.
В результате перегруппировки атомы или атомные группы внутри молекулы меняются местами, иногда без сохранения элементного состава, например при пинакон-пинаколиновой перегруппировке:
При изомеризации, частном случае перегруппировки элементный состав сохраняется.
Многие перегруппировки обратимы. Если структурные изомеры находятся в состоянии равновесия, то такие изомеры называются таутомерами, то есть таутомерия является частным случаем реакции изомеризации. На величину ΔS в таких реакциях более существенное влияние оказывает изменение степени свободы вращательного движения.
Окисление и восстановление.
Как и для неорганических, весьма распространенными для органических соединений являются окислительно-восстановительные реакции.
- Окисление — образование новых связей углерода с более электроотрицательными элементами (галогены, кислород, азот, сера, фосфор и др.), но обычно с кислородом.
- Восстановление — образование новых связей С—Н.
Типы химических реакций
Существует пять типов химических реакций. В ходе реакции материя не создается и не разрушается. Атомы просто перестраиваются, чтобы продукты химически отличались от исходного реагента или реагентов. Реагенты — это вещества, которые вступают в реакцию и обычно находятся слева от стрелки в формуле. Тепловая энергия может теряться во время этого процесса в результате экзотермической или поглощаться в ходе эндотермической реакции.
Каждый из типов реакций включает в себя общее изменение энергии, а также перегруппировку атомов/молекул. В результате перегруппировки образуются продукты реакции. Продукт(ы) находятся справа от стрелки в формуле.
Химическая реакция происходит, когда вещество претерпевает изменение. Это изменение меняет идентичность вещества, а также его свойства. Существует несколько типов изменений.
Примеры подобных изменений включают, помимо прочего:
- Горение
- Окисление (ржавление)
- Ферментация
- Реакция кислот и оснований
- Пищеварение
Есть несколько индикаторов того, что произошло изменение/химическая р-ция. К ним относятся:
- Выделение тепла или света
- Осадок (твердые вещества) может образовываться
- Может произойти изменение цвета
- Может образоваться газ (часто проявляется в виде пузырьков).
Типы реакций:
- соединения (синтеза) – две или более вещей объединяются в одно.
- разложения – одно вещество распадается на два и более.
- однократного замещения – один элемент заменяет что-то в соединении.
- двойного замещения – два соединения заменяют один из своих компонентов.
- горения — углеводород реагирует с кислородом с образованием углекислого газа и воды.
Реакция соединения (синтеза)
Реакция соединения, также известная как синтез, включает объединение двух или более элементов и/или веществ для создания нового вещества. В зависимости от типа образующегося соединения, электроны и их энергия передаются от одного иона к другому (ионное соединение); или пары электронов распределяются между двумя или более атомами (ковалентное соединение), образуя новое единое соединение.
Простой формат соединения выглядит следующим образом:
A + B —> AB

Соединение металлического магния и газообразного кислорода приводит к образованию оксида магния.
Реакция разложения
Она происходит, когда одно вещество химически распадается на два или более компонентов.
Простой формат реакции разложения выглядит так:
AB —> A + B
Реакция однократного замещения
В ней, один элемент заменяет один из ионов в ионном соединении. Положительно заряженный катион может быть заменен только атомом, который также может действовать, как катион. Отрицательно заряженный анион можно заменить только атомом, действующим как анион.
Простой формат реакций однократного замещения при замене катиона выглядит следующим образом:
A + BC —> B + AC
Она может выглядеть так, если замещается анион:
Y + XZ —> XY + Z
Реакция двойного замещения
В двойном замещении два ионных соединения обмениваются ионами. Они либо поменяют местами свои положительно заряженные катионы, либо поменяют местами отрицательно заряженные анионы. Простой формат реакции выглядит следующим образом:
AB + CD —> CB + AD
Реакция горения
Реакции горения требуют в качестве реагентов углеводорода и большого количества кислорода. Углеводород – это молекула, содержащая только водород и углерод. Продуктами сгорания всегда будут углекислый газ и вода.
Простой формат горения выглядит так:
CxHy +O2 —> CO2 + H2O

Фейерверки — хороший пример горения, и наблюдать за ними тоже интересно!
Тепловой эффект
Классификация хим. реакций по этому признаку основывается на выделении или поглощении тепловой энергии. Если в результате химического взаимодействия тепло выделяется, то это экзотермическая реакция. Эндотермическая — это такая, при которой тепло будет поглощаться.
Расчет тепловой энергии ведется на основе закона Гесса, который гласит, что тепловой эффект химической реакции не зависит от пути ее протекания. Кратко вычисление можно записать, как разницу между энтальпиями образования продуктов и реагентов.

Пример:
S + O2 = SO2 +Q (экзотермическая)
CaCO3 = CaO +CO2 -Q (эндотермическая)
I. Систематизация реакций в химии неорганических веществ. Примеры
- В процессе окисления-восстановления меняется степень окисления химических элементов:
Al + S → Al2+3S3-2
В этом примере к атому серы присоединяются два электрона – это полуреакция восстановления. Окислительная степень её сменилась с 0 до -2.
Сера здесь – окислитель (акцептор электронов).
Атом алюминия, отдав 3 электрона, изменил степень окисления с 0 до +3 и стал восстановителем (донором электронов). Это окислительная полуреакция.
Обе полуреакции составляют единый окислительно-восстановительный процесс.
- При проведении реакции соединения несколько реагентов образуют только один продукт:
4NO2 +O2 +2H2O=4HNO3
-
Разложение наоборот продуцирует из одного химического реагента два или несколько других:
CaCO3 = CaO + CO2
- Взаимодействие простого и сложного вещества, которое ведёт к образованию других простых и сложных веществ, называется реакцией замещения:
Zn + CuSO4 = ZnSO4 + Cu
-
В обменной реакции участвующие в ней реагенты меняются своими структурными частями:
2NaOH + CuCl2 = 2NaCl + Cu(OH)2
Частным случаем этого процесса является нейтрализация между собой кислот и оснований:
KOH + HCl = KCl + H2O
- Классифицирующий признак «направление реакции» разделяет их на необратимые и обратимые. Если в ходе необратимой процесс идёт только в одном направлении до получения конечных продуктов, то в обратимой реакции он протекает в прямом и противоположном направлениях:
3H2 + N2 ⇆ 2NH3 – обратимая реакция,
- Преобразование веществ обязательно сопровождается разрывом связей в молекулах и созданием новых.
Если этот разрыв сопровождается образованием радикалов, что присуще молекулам с неполярными и малополярными ковалентными связями, то этот процесс — гомолитическая реакция:
Cl2свет→ Cl∙ + ∙Cl
Каждая частица хлора, обладая неспаренным электроном, превращается в радикал. Реакции, связанные с разрывом сильнополярных связей и образованием заряженных частиц – ионов, являются гетеролитическими:
HBr ⇆H+ +Br–
- Любое химическое превращение – это энергетический процесс. Поэтому ещё один показатель химического реагирования – тепловой эффект.
Реакции, идущие с выделением тепловой энергии, называются экзотермическими. Практически все реакции соединения – экзотермические.
Если им ещё сопутствует световое излучение, то такая реакция носит название горение.
C + O2 = CO2 + Q, где Q – тепловой эффект.
Взаимодействие веществ с поглощением тепла эндотермическая реакция. К такому типу относятся реакции разложения:
CaCO3 → CaO + CO2 – Q
Для сведения. Уравнения, демонстрирующие тепловой эффект (Q), носят название термохимические.
- Группа гомогенных и гетерогенных реагирований определяется фазным (агрегатным) состоянием веществ.
В гомогенных – все исходные и полученные в ходе реакции вещества существуют в одной фазе. Например, в растворах, в газообразной среде:
NaOH(р-р) + HCl(р-р) = NaCl + H2O
2CO + O2 = 2CO2
Если реагенты и полученные продукты находятся в разных фазовых состояниях, то речь идёт о гетерогенном взаимодействии:
-
Большая группа реакций определяется участием в них особых веществ – катализаторов, т.е. соединений – ускорителей реакции.
Каталитические реакции идут только с их участием:
2H202MnO2→ 2H2O + O2 (катализатор MnO2)
Некаталитические реакции в присутствии катализаторов не нуждаются:
КOH + HCl → КCl + H2O
Для сведения. Существуют также вещества, которые замедляют химические реакции – ингибиторы. В ходе реакций ни катализаторы, ни ингибиторы не расходуются и не изменяются.
Классификация по числу и составу исходных и образующихся веществ
Реакции, идущие без изменения состава веществ
Химических реакций, идущих без изменения числа и состава исходных веществ и продуктов реакции не так много. В неорганической химии — это реакции образования простых веществ (аллотропных модификаций) одним и тем же элементом, с разным строением и свойствами,
например: S8 ромбическая → S8 моноклинная
В органической химии к таким реакциям относятся реакции перестройки углеродных цепей (изомеризация), когда из одного вещества под действием определенных условий, создаваемых для реакции(температура, применение катализатора), образуется вещество с другой структурой, но тем же составом — изомер.
Например, образование из бутана изобутана (2-метилпропана):
CH3-CH2-CH2-CH3 ⇒ CH3-CH(CH3)-CH3
Реакции с изменением состава веществ
- схема реакции соединения
В неорганической химии к реакциям соединения относятся
В органической химии подобные реакции называются реакциями присоединения
гидрирования (присоединение водорода)
СН2=СН2 + Н2 ⇒ СН3 — СН3
галогенирования (присоединение галогенов: хлор, бром, йод)
СН2=СН2 + Сl2 ⇒ СН2Сl — СН2Сl
гидрогалогенирования (присоединение галогеноводородов — НГаl)
СН2=СН2 + НСl ⇒ СН3 — СН2Сl
гидратации (присоединение воды)
СН2=СН2 + Н2О ⇒ СН3 — СН2ОН
полимеризации (присоединение молекул друг к другу при наличии в них кратных связей)
nСН2=СН2 + СН2 = СН2 ⇒ ( — СН2 — СН2 -)n (реакция получения полиэтилена)
- схема реакции разложения
Реакции разложения в органической химии разделяют на собственно реакции разложения, которые происходят с разрывом углеродной цепи и реакции отщепления.
Реакции отщепления или элиминирования — это реакции, в процессе которых от исходной молекулы отрываются атомы или или группы атомов, а углеродный скелет молекулы сохраняется. В названии таких реакций используют приставку «де».
Например реакция дегидрирования пропана: СН3 — СН2 — СН3 ⇒ СН2 = СН — СН3 + Н2
Пример реакции разложения (крекинга) гексана C6H14 ⇒ С3Н8 + С3Н6
В реакциях разложения (термического расщепления) органических веществ происходит разрыв углеродной цепи молекулы на более короткие цепочки. Такие реакции протекают в жестких условиях при высокой температуре (400-500 ºС) и в присутствии катализатора. Этот процесс является важнейшей стадией переработки углеводородов.
- схема реакции замещения
Пример реакции взаимодействия соляной кислоты с цинком: 2НСl + Zn ⇒ ZnCl2 + H2
Замещаться могут не только отдельные атомы, но и молекулы
Например, при сплавлении оксидов с солями, менее летучие оксиды вытесняют более летучие из солей. Так, нелетучий оксид кремния вытесняет оксид серы (IV) из сульфита натрия при сплавлении:
Например, реакция хлорирования метана: CH4 + Cl2 ⇒ CH3Cl + HCl
По числу исходных частиц и составу продуктов эта реакция больше похожа на реакцию обмена, но по механизму такая реакция является реакцией замещения
- схема реакции обмена AB + CD = AC + ВD
Например:Fe2(SO4)3 + 3BaCl2 ⇒ 3BaSO4↓ + 2FeCl3
В неорганической химии большинство реакций обмена протекают в растворах электролитов между ионами и поэтому их называют реакциями ионного обмена или ионными реакциями
Реакции ионного обмена идут до конца в трех случаях:
Образование осадка:
Fe2(SO4)3 + 3BaCl2 ⇒ 3BaSO4↓ + 2FeCl3 (уравнение в молекулярном виде)
Ионные уравнения : 2Fe3+ + 3SO42- + 3Ba2+ + 6Cl— → 3BaSO4 ↓ + 2Fe3++ 6Cl— (полное)
3Ba2+ + 3SO42- → 3BaSO4 (сокращенное)
Образование газообразного вещества
Образование малодиссоциирующего вещества — воды
NaOH + HNO3 ⇒ NaNO3 + H2O (молекулярное)
Ионные: Na++OH— + H++ NO3— ⇒ Na+ + NO3— + H2O (полное)
H+ +OH— ⇒ H2O (сокращенное)
Классификация по участию катализатора
При осуществлении многих химических реакций, требуется ускорить их протекание, особенно при производстве важных и необходимых продуктов, или наоборот замедлить те химические реакции, которые с точки зрения пользы и вреда для человека — нежелательны, например, ржавление железных конструкций. В таких случая большая роль принадлежит специальным веществам, которые либо ускоряют химический процесс, либо замедляют его.
Независимо от того, в какой среде протекает химическая реакция – гомогенной или гетерогенной, сущность действия катализаторов одна и та же: катализаторы активно участвуют в данной реакции с образованием различных промежуточных соединений.
Например, реакция этилена с водой. Для ее протекания применяют в лабораторных условиях применят серную кислоту, а при производстве этанола – ортофосфорную. Этилен непосредственно с водой не реагирует.
Механизм реакции:
На первой стадии образуется промежуточный продукт — этилсульфат CH2=CH2 + Н – О – SО2 – ОН → СН3 – СН2 – О — SО2 – ОН (этилсульфат)
На второй стадии этилсульфат взаимодействует с водой: СН3 – СН2–О — SО2–ОН + НОН → СН3–СН2–ОН + НО–SО2 –ОН
Реакции, которые идут без участия катализаторов, называются некаталитическими.
Многие реакции протекают без участия катализаторов, например реакции взаимодействия сульфата меди (II) с гидроксидом натрия:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
В клетках живых организмов все реакции протекают с участием веществ белковой природы — ферментов — биологических катализаторов
Реакции с участием ферментов называют ферментативными
Классификация по природе реагирующих частиц
Гомолитические (радикальные) реакции
Гомолитические (радикальные) реакции идут с участием радикалов — частиц с неспаренным электроном:
СН4 + Сl• → СH3• +НСl
Гетеролитические (ионые) реакции
Гетеролитические (ионные) реакции идут с участием ионов, а также частиц с неподеленной парой электронов или вакантной орбиталью, то есть нуклеофилов и электрофилов. Если атакующая частица (реагент) является нуклеофилом, то говорят, что реакция нуклеофильная, если электрофил, то реакция электрофильная: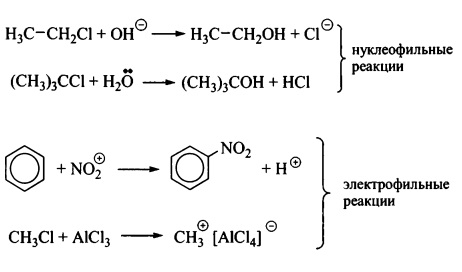 Объект атаки называется субстратом. Деление взаимодействующих частиц на субстрат и реагент достаточно условно, обычнопоследним является более простая, активная частица.
Объект атаки называется субстратом. Деление взаимодействующих частиц на субстрат и реагент достаточно условно, обычнопоследним является более простая, активная частица.
Типы химических реакций по наличию катализатора
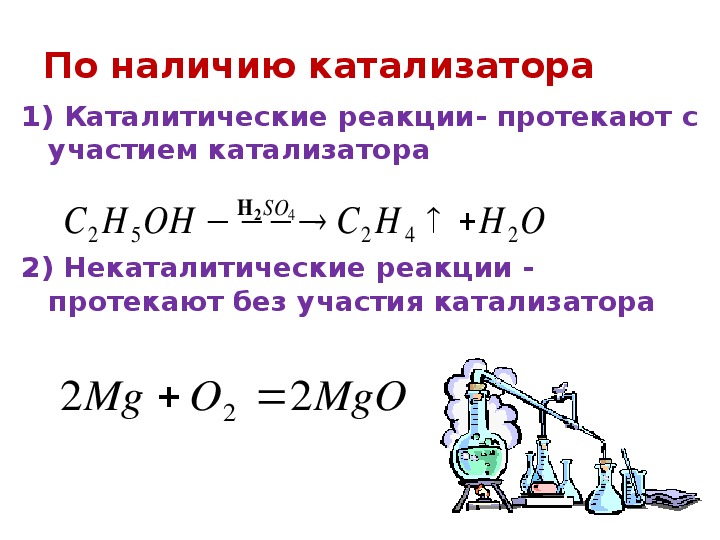
Катализатор – вещество органической или неорганической природы, понижающее энергию активации, таким образом, повышающий её скорость. Примерами классификации химических реакций по необходимости наличия катализатора являются каталитические (катализатор присутствует) и некаталитические (отсутствие катализатора) превращения веществ.
Каталитические
Каталитическими называют химические превращения, для протекания которых необходимо наличие катализатора. Катализаторы по своему происхождению подразделяются на:
- биологические (ферменты ЖКТ у человека: трипсин, ренин, химотрипсин, пепсин и т.д.)
- органические (алкалоиды: никотин и хинин)
- неорганические (платина, палладий)
Пример р., протекающей в присутствии катализатора: Белок + Н2О = хАминокислоты (данное превращение каждые 1,5 часа протекает в организме человека в присутствии пептидаз –биологических катализаторов, гидролитически разрывающих пептидных связи)
Некаталитические
Некаталитическими называют химические превращения, которые могут протекать без присутствия катализатора. Пример: р. соединения магния и кислорода с образованием оксида магния: 2Mg + О2 = 2MgО.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Классификация химических реакций на основании их признаков.
|
в результате таких реакций из двух или более исходных веществ образуется только один продукт, например: С + O2 = CO2 4NO2 + O2 + 2H2O = 4HNO3 |
|
|
в таких реакциях из одного вещества образуется два или больше других веществ: 2KMnO4 = K2MnO4 + MnO2 + O2 CaCO3 = CaO + CO2 |
|
замещенияВсе реакции, в результате которых из простого и сложного веществ образуется другое простое и другое сложное вещества. Например: Zn + CuSO4 = ZnSO4 + Cu В органической химии, под реакциями замещения подразумевают также такие реакции, в результате которых происходит замена атома водорода или заместителя прикрепленного к углеродному скелету молекулы, на другой заместитель. Подробнее — в таблице ниже посвященной классификации реакций в органической химии. |
|
обменаРеакциями обмена называют такие реакции, в результате которых вещества меняются своими составными частями. Например: 2NaOH + CuCl2 = 2NaCl + Cu(OH)2 Частный случай реакции обмена между кислотой и основанием носит также название реакции нейтрализации: NaOH + HCl = NaCl + H2O многие реакции органической химии, в которых вещества меняются своими составными частями относят к реакциям замещения. Подробнее — в таблице ниже посвященной классификации реакций в органической химии. |
|
обратимыетакие реакции обладают способностью протекать как в прямом, так и обратном направлении. Реакции, про которые обязательно нужно знать, что они обратимые: |
|
необратимыеТакие реакции протекают только в прямом направлении. Если речь идет о реакциях между электролитами, то необратимой реакция является в том случае, если образуется осадок, газ или малодиссоциирующее вещество. Например: Na2CO3 + 2HCl = 2NaCl + H2O + CO2 В качестве малодиссоциирующих веществ в реакциях ионного обмена могут образоваться вода, слабые кислоты, гидроксид аммония. |
|
экзотермическиеВ результате таких реакций выделяется энергия в виде теплоты. Обозначают такие реакции, добавляя «+Q» к уравнению реакции, например: |
|
эндотермическиеПри протекании таких реакций поглощается тепло. Для обозначения таких реакций пишут «-Q» в уравнении реакции. Практически все реакции разложения являются эндотермическими: Исключения: реакции разложения HI и NO являются экзотермическими. |
|
гомогенныеГомогенными реакциями называют такие реакции, реагенты в которых находятся в одной фазе. Примерами таких реакций могут быть многие реакции протекающие в растворах, реакции между газообразными веществами: NaOH (р-р) + HCl(р-р) = NaCl + H2O 2CO + O2 = 2CO2 В гомогенных реакциях не наблюдаются границы раздела между реагентами |
|
гетерогенныегетерогенными реакциями называют такие реакции, в которых реагирующие вещества находятся в разных фазах. Примерами таких реакций являются, взаимодействие цинка с раствором соляной кислоты, взаимодействие углекислого газа с известковой водой, и т.д.: |
|
Уравнения химических реакций
Вещества образуются во время химических процессов. Каждое соединение имеет химическую формулу. Чтобы описать происходящий процесс языком химии, используют уравнения реакций.
Используя постулаты атомно-молекулярного учения, можем сказать, что образование новых веществ является следствием перегруппировки атомов.
Возьмём медную проволоку и нагреем в пламени горелки. Медь металл красного цвета, после нагревания становится чёрной. Что с ней произошло?
Кислород О2 и медь Cu относятся к простым соединениям, образуют сложное соединение CuO.Чтобы описать данный процесс, используем символы в схеме реакции. Слева от стрелки реагенты, справа находятся продукты реакции.
Cu + O2 → CuO
Обратите внимание на рисунок и на схему. Согласно рисунку, чтобы произошла реакция, берут два атома Меди и одну молекулу кислорода О2
В следствии образуется две молекулы CuO оксида меди (II). Схема показывает, что до реакции 1 атом меди и молекула кислорода образуют сложное вещество CuO. Так как не появился новый вид атомов, а произошла только их перегруппировка, то их количество должно быть равно. Посмотрев на схему, можно увидеть, что количество отличается:
|
До реакции |
После реакции |
||
|
Cu |
1 |
= |
1 |
|
O |
2 |
> |
1 |
Чтобы схема стала уравнением, используем закон сохранения массы вещества (ЗСМВ), который был открыт Михаилом Васильевичем Ломоносовым. До его открытия, ЗСМВ носил разнообразные названия. Древние философы называли его «Законом сохранения атомов», а точнее «Принципом сохранения и неуничтожимости материи».
Используя ЗСМВ сделаем схему уравнением реакции, т.е. уравняем левую и правую части. Начнём с Кислорода. В правой части поставим 2 перед формулой (надеемся, Вы помните, что коэффициенты ставят перед формулой и никак не в средине)
Cu + O2 → 2CuO
Наверняка вы заметили, что изменилось количество атомов меди после реакции, чтобы было поровну, поставим 2 перед Cu.
2Cu + O2 → 2CuO
Следуя данному алгоритму, расставим коэффициенты в уравнении реакции
CH4 + O2 → CO2 + H2O
Начнём с Углерода, до реакции 1, после реакции 1. 1 = 1
Водород 4 > 2. Выбираем НОК (наименьшее общее кратное), это 4. Делим на индексы. До реакции 4/4 = 1. Значит перед СН4 должен быть коэффициент 1. После реакции 4/2 = 2. Перед Н2О ставим 2.
CH4 + O2 → CO2 + 2H2O
Кислород 2
Обратите внимание, Кислород входит в состав СО2 и Н2О, и перед водой стоит коэффициент 2. В сумме выходит 4
НОК равно 4. Выполнив аналогичные действия, как и с Водородом. Получаем коэффициент 2 перед О2.
CH4+ 2O2 → CO2 + 2H2O
Следует обратить внимание, что существуют так называемые «группы» атомов – кислотные остатки и гидроксо-группа –ОН. С ними Вы познакомитесь чуть позже, а сейчас рассмотрим принцип расстановки коэффициентов, используя эти группы
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна





























