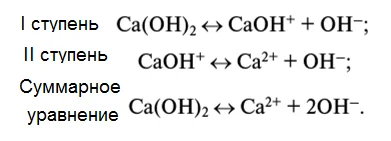Растворение — что это за процесс
Особенностью растворенного вещества является равномерное распределение в объеме вещества, которое играет роль растворителя. Для раствора характерно содержание двух и более компонентов.
Виды растворов:
- жидкие;
- твердые;
- газообразные.
Когда смешивают вещества с идентичными агрегатными состояниями, к примеру, жидкость с жидкостью, газ с газом, твердый материал с твердым, роль растворителя играет компонент с большим содержанием. Процесс, при котором образуется раствор, определяется особенностью взаимодействия частиц растворителя с частицами растворенного вещества и их природой.
Растворение представляет собой результат взаимодействия молекул вещества, играющего роль растворителя, с частицами растворенного вещества. При растворении твердых веществ наблюдают увеличение энтропии. В процессе растворения газообразных веществ энтропия уменьшается. Растворение сопровождается исчезновением межфазной границы, изменением физических свойств раствора, в том числе плотности, вязкости, в некоторых случаях, окраски.
Когда растворитель и растворенное вещество участвуют в химическом взаимодействии, можно наблюдать изменение химических свойств раствора. В качестве примера можно привести растворение газа хлороводорода в воде, результатом которого является образование жидкой соляной кислоты.
Теплота растворения зависит от природы компонентов раствора.
Например: если растворяются кристаллические вещества с растворимостью, увеличивающейся при повышении температуры, то раствор охлаждается. Это объясняется тем, что раствор обладает большей внутренней энергией по сравнению с аналогичными характеристиками кристаллического вещества и растворителя, взятых по отдельности. Как пример, можно рассмотреть кипяток, в котором происходит растворение сахара. В результате раствор значительно охлаждается.
Диссоциация оснований
При диссоциации оснований роль анионов играют гидроксид-ионы (ОH-), других анионов при диссоциации оснований не образуется:
NaOH Na+ + OH-
Кислотность основания определяется кол-вом гидроксид-ионов, образующихся при диссоциации одной молекулы основания:
- однокислотные основания — KOH, NaOH;
- двухкислотные основания — Ca(OH)2;
- трехкислотные основания — Al(OH)3.
Многокислотные основания диссоциируют, по аналогии с кислотами, также ступенчато — на каждом этапе отщепляется по одному гидроксид-иону:
Zn(OH)2 ZnOH+ + OH- ZnOH+ Zn2+ + OH-
Некоторые вещества, в зависимости от условий, могут выступать, как в роли кислот (диссоциировать с отщеплением катионов водорода), так и в роли оснований (диссоциировать с отщеплением гидроксид-ионов). Такие вещества называются амфотерными (см. Кислотно-основные реакции).
Диссоциация Zn(OH)2, как основания:
Zn(OH)2 ZnOH+ + OH- ZnOH+ Zn2+ + OH-
Диссоциация Zn(OH)2, как кислоты:
Zn(OH)2 + 2H2O 2H+ + [Zn(OH)4]2-
Классификация и свойства кислот
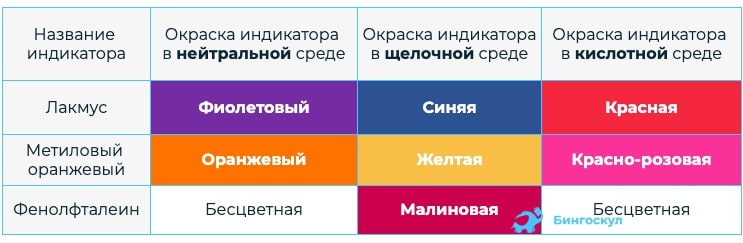
Кислоты – это жидкие (например, H2 SO4 – серная кислота) и твердые (например, H3PO4-ортофосфорная кислота) смеси. Большинство кислот хорошо растворимы в воде. Но есть и нерастворимые, типичный пример, H2 SiO3 – кремниевая кислота. Кислоты способны разъедать кожу и ткани. К физическим свойствам кислот можно отнести то, что они изменяют цвет индикаторов: лакмуса – в красный, метиловый оранжевый – в розовый, фенолфталеин – в бесцветный.
Рис. 1. Таблица изменение цвета индикаторов на кислоты.
С точки зрения теории электролитической диссоциации, кислоты – это электролиты, способные диссоциировать в водном растворе с образованием в качестве катионов только ионов водорода. Следовательно, кислоты можно называть протолитами, то есть веществами отдающими протон.
С помощью количества атомов водорода, способных замещаться на металл, определяет основность кислоты: одноосновные кислоты – HBr, HClO2; двухосновные – H2SO3, H2S; трехосновные – H3PO4 (ортофосфорная кислота) и т.д.
Рис. 2. Формула ортофосфорной кислоты в молекулярно-ионном виде.
Кислоты делятся на кислородные и бескислородные (пример первых – HNO3, вторых – HCl).
Названия бескислородных кислот строятся следующим образом: к корню русского названия неметалла, образующего кислоту, прибавляется буква о и слово «водородная». Например: HCl – хлороводородная кислота, H2S – сероводородная кислота.
Название кислородных кислот образуется от русского названия центрального элемента с прибавлением различных суффиксов, характеризующих степень его окисления, и слова «кислота».
432Рис. 3. кислородные и бескислородные кислоты.
Реакции гидролиза солей
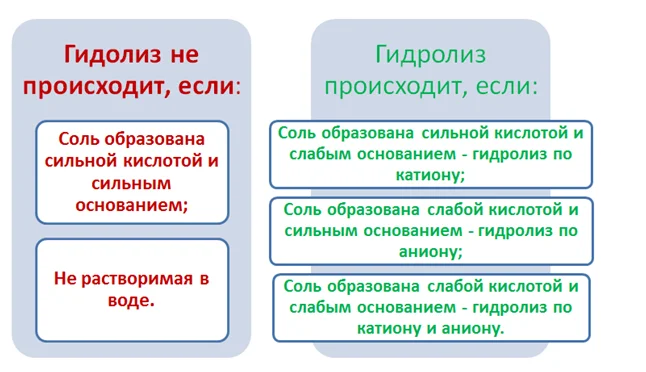
Если слабого электролита в результате взаимодействия с водой не образуется, то реакция гидролиза просто не идет. Это происходит в том случае, если соль образована катионом сильного основания и анионом сильной кислоты (например NaCl, K2SO4, NaNO3). Их водные растворы нейтральны (pH=7):
NaNO3+H2O= (не идет)NaOH+HNO3 – реакция не идет
Во всех остальных случаях реакция гидролиза идет:
соль образована катионом слабого основания и анионом сильной кислоты: например, соли хлорид аммония NH4Cl, нитрат цинка Zn(NO3)2.
window.__clADF__.cmd.push(()=>{
Ya.adfoxCode.create({
ownerId: 719711,
containerId: ‘basic_640x290_2’,
params: {
pp: ‘g’,
ps: ‘gdho’,
p2: ‘hyof’,
pk: __clADF__.state,
}
})
})
Их водные растворы имеют кислую реакцию (pH меньше 7).
Пример гидролиза солей хлорида аммония:
NH4Cl+H2O=NH4OH+HCl
NH4+Cl+H2O=NH4OH+H+Cl
NH4+H2O+NH4OH+H
NH4OH – слабый электролит
Рис. 2. Хлорид аммония.
- соль образована катионом сильного основания и анионом слабой кислоты: например, соли ацетат натрия CH3COONa, карбонат натрия (сода) Na2CO3. Их водный раствор имеет щелочную реакцию (pH больше 7), гидролиз идет по аниону соли, по первой ступени. Например, карбонат натрия Na2CO3 диссоциирует в водном растворе на ионы натрия и карбонат-ионы, далее карбонат-ионы реагируют с водой.
- наиболее полному гидролизу подвергаются хорошо растворимые соли, образованные катионом слабого основания и анионом слабой кислоты: например, ацетат аммония CH3COONH4. В этом случае гидролиз идет до конца и по аниону, и по катиону, а характер среды практически нейтральный. Гидролиз ацетата аммония протекает согласно уравнению:CH
3COO- +NH4+ +H2O=CH3COOH + NH4OH
Раствор ацетата аммония практически нейтрален (pH=7), так как константы диссоциации уксусной кислоты и гидроксида аммония практически одинаковы
В рамках ионной теории Аррениуса механизм протекания гидролиза объясняется следующим образом. Вода, хотя и в незначительной степени, диссоциирует на ионы H+ и ОН-. Если в результате гидролиза образуется малодиссоциирующее основание, то часть ионов ОН- оказываются связанными, а равное им количество ионов Н+ – свободными, что и обуславливает кислую реакцию раствора. Наоборот, если в результате гидролиза связывается часть ионов Н+, то равное им количество ионов ОН- остается свободным, что и обуславливает щелочную среду раствора.
Рис. 3. Теория Аррениуса.
Что мы узнали?
В 11 классе по химии подробно изучается тема «Гидролиз солей». В данной статье дается определение гидролиза, а также разъяснения в каких случаях реакция гидролиза может происходить, а в каких реакция отсутствует.
-
/10
Вопрос 1 из 10
Химические свойства кислот
Характерные химические свойства кислот связаны в первую очередь с взаимодействием с веществами, проявляющими основные свойства, кроме того, для растворимых кислот характерны реакции ионного обмена.
Электролитическая диссоциация
Растворимые кислоты диссоциируют в водном растворе с образованием катионов водорода, например:
Катионы водорода, присутствующие в растворах кислот, изменяют цвет индикаторов.
Взаимодействие с основаниями
Взаимодействие с основаниями, или реакция нейтрализации, протекает достаточно легко. В результате реакции образуются соль и вода, например:
Взаимодействие с основными и амфотерными оксидами
Реакции кислот с основными и амфотерными оксидами протекают хорошо в случае сильных кислот или активных оксидов (оксиды ЩМ и ЩЗМ), в остальных случаях для протекания реакции может потребоваться нагревание реакционной смеси. В ходе таких реакций образуется соль и вода:
Взаимодействие с солями
Кислоты могут вступать в реакции как с растворами солей, так и с твердыми солями, в том числе некоторыми нерастворимыми.
С растворимыми солями полностью реакция в растворах протекает в случаях, когда в результате ионного обмена образуется осадок, вода или газ. В качестве осадка может служить нерастворимое основание или соль:
Нелетучие кислоты способны вытеснять летучие из их солей. В случае летучих кислот, имеющих хорошую растворимость в воде, для более полного протекания реакции используют концентрированные кислоты и твердые соли, реакцию при этом проводят при повышенной температуре.
Реакция протекает за счет образования газообразного вещества — хлороводорода.
В реакциях с твердыми солями более сильные кислоты вытесняют более слабые из состава солей.
Однако существуют исключения, например, сероводородная кислота способна вытеснять даже сильные кислоты при образовании так называемых «черных сульфидов» (, , и некоторых других):
Взаимодействие с металлами
Кислоты и их растворы (за исключением особых кислот-окислителей) способны взаимодействовать с активными металлами до водорода в ряду напряжений, окисляя их за счет атомов водорода в степени окисления +1. В ходе таких реакций образуется соответствующая соль и выделяется водород:
Разложение неустойчивых кислот
Некоторые кислоты способны разлагаться в момент образования или при определенных условиях. Например, сернистая и угольная кислота разлагаются в момент образования даже в разбавленных растворах при комнатной температуре:
Кремниевая кислота неустойчива при высоких температурах:
Азотная кислота разлагается на свету:
Применение РИО
Во многих отраслях индустрии, сельском хозяйстве, в решении проблем экологии используются реакции ионного обмена. Несколько примеров применения РИО.
- Для обессоливания (деминерализации) воды с помощью катионитных и анионитных колонок. Катиониты поглощают ионы Ca2+, Mg2+, заменяя их на ионы H+. На анионите группа OH- заменяется анионами Cl-. В итоге получается почти дистиллированная вода.
- Для опреснения воды в космических кораблях и морских судах.
- Для обеспечения ионного обмена в почвах, что помогает улучшению их агротехнических свойств.
- Для извлечения ценных примесей (уран, золото, серебро).
- Для удаления ионов тяжелых металлов при очистке промышленных сточных вод.
В заключении интересный факт: домашние хозяйки, сами того не зная, используют правило Бертолле, когда применяют реакцию ионного обмена между столовым уксусом и пищевой содой. Выделяющийся при этом газ способствует «поднятию» теста.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакции ионного обмена протекали, необходимо, чтобы выполнялись не только условия: образование осадка, газа или воды, но и вещества –реагенты должны быть растворимыми.
Например:
- CuS + Fe(NO3)2 ≠ FeS + Cu(NO3)2
реакция не идет, потому что FeS – нерастворим, а так же нерастворимой солью является соль – реагент сульфид меди — (CuS).
- Na2CO3 + CaCl2 = CaCO3
реакция протекает, так как карбонат кальция нерастворим и соли – реагенты являются растворимыми.
↓+ 2NaCl
- Cu(OH)2 + Na2S – не протекает,
- Чтобы соль с основанием реагировали, необходима растворимость их обоих.
- Cu(OH)2 — нерастворим, хотя потенциальный продукт CuS был бы осадком. В одной системе 2-х осадков не бывает.
- 2NaOH + Cu(NO3)2 = Cu(OH)2 ↓+ 2NaNO3
- реакция протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
- Это требование не распространяется на растворимость исходных веществ дальше реакций соль1+ соль2 и соль + основание.
- Все растворимые кислоты реагируют со всеми карбонатами, в том числе нерастворимыми.
Вывод:
- Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
- Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть садок или гидроксид аммония.
Смотри также:
- Классификация химических реакций в неорганической и органической химии
- Тепловой эффект химической реакции. Термохимические уравнения
- Скорость химической реакции, ее зависимость от различных факторов
- Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
- Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
- Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
- Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
- Электролиз расплавов и растворов (солей, щелочей, кислот)
- Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
Химические свойства
Изменение цвета индикаторов
Кислота в водной среде способна изменить цвет разных индикаторов. Кислоты окрашивают в красных цвет лакмус, метилоранж и универсальный индикатор. Фенолфталеин не окрашивается.
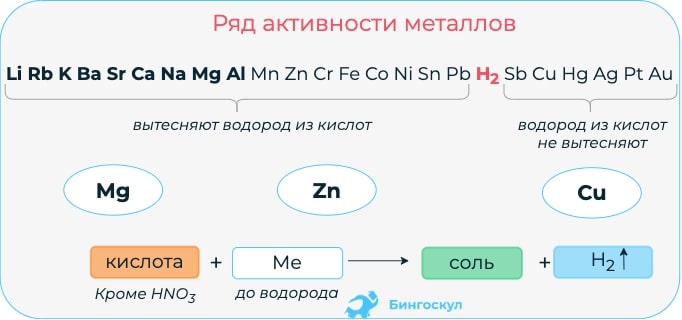
Взаимодействие кислот с металлами
Кислота способна реагировать только с металлами, находящимися левее водорода в ряду активности металлов.
Из приведенного выше химического уравнения нужно отметить, что при взаимодействии кислоты и металла происходит реакция замещения, образуется соль и выделяется H2.
Взаимодействие кислот с основными и амфотерными оксидами
При взаимодействии кислоты с основным или амфотерным оксидами происходит реакция обмена в результате которой образуются соль и H2O.
В качестве примера приведены следующие реакции:
K2O + 2HNO3 → 2KNO3 + H2O Al2O3 + 6HCl → 2AlCl3 + 3H2O
Из приведённого выше химического уравнения нужно отметить, что в реакциях основного оксида калия и амфотерного оксида алюминия (III) с кислотами, образуется соль и H2O.
Взаимодействие кислот с основными и амфотерными гидроксидами
При взаимодействии кислоты с основным и амфотерным гидроксидами образуются H2O и новая соль, как и в случае с оксидами, происходит реакция обмена. Второе название этой реакции — реакция нейтрализации.
KOH + HNO3 → KNO3 + H2O Al(OH)3 + 3HCl → AlCl3 + 3H2O
Из приведённой выше химического уравнения нужно отметить, что при реакции основного гидроксида калия и амфотерного гидроксида алюминия (III) с кислотами образуются соль и H2O.
Взаимодействие кислот с солями
Реакция кислоты с солью является реакцией обмена, так же ее называют реакцией нейтрализации. Она возможно только в случае выпадения соли в осадок, выделения газа, слабые электролиты или вода. Рассмотрим все случаи более подробно.
- Реакции, в результате которых выпадает осадок.
H2SO4 + BaCl2 → BaSO4↓ + 2HCl Na2SiO3 + 2HNO3 → H2SiO3↓ + 2NaNO3
Из приведённого выше химического уравнения можно увидеть, что при взаимодействии кислоты и соли образуются новые кислота и нерастворимая соль, которые выпадают в осадок. Осадок может иметь различную окраску, плотность и консистенцию.
- Реакции, в результате которых при нагревании или обычных условиях выделяется газ.
Из приведённых выше химических уравнений нужно отметить, что при реакции соли с кислотой образуется новая соль и выделяется газ. Разберём одну из реакций: при взаимодействии твёрдого хлорида натрия с концентрированной хлороводородной кислотой образовалась натриевая соль серной кислоты и выделился летучий газ хлороводород.
- Реакции, в результате которых образуется слабый электролит.
Такие реакции возможны только при условии, когда одним из реагентов сильный электролит. Для того, чтобы убедиться, что реакция будет протекать используют вытеснительный ряд:
В этом ряду кислоты расположены так, что в растворах кислот и их солей могут в результате реакции вытесняют из раствора те, что стоят левее в ряду. Азотная и фосфорная кислоты находятся на одном месте в ряду, т.к. имеют одинаковые вытеснительные способности.
Из приведённого выше химического уравнения нужно отметить, что хлороводородная кислота, которая находится в данном ряду левее, способна вытеснять кислотный остаток карбоновой кислоты, стоящей в ряду правее. Нужно учитывать, что карбоновая кислота слабая и при стандартных условиях она распадется на углекислый газ и воду. Углекислый газ выделяется из раствора, а вода остаётся.
Разложение кислородсодержащих кислот
В результате реакции разложения кислородсодержащих кислот всегда образуется вода и оксид.
Из приведённых выше реакций можно увидеть, что карбоновая легко разлагается при обычных условиях, так как является одной из самых слабой кислотой. Для разложения сернистой и кремниевой кислоты их растворы необходимо нагреть. Во всех трёх реакция в результате образуется вода и оксиды кислотных остатков.
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
Физические свойства и классификация оснований
Основания — твердые вещества, преимущественно белого цвета, хотя встречаются и других цветов. Например, гидроксид меди — голубой, гидроксид железа — коричневый.
По способности растворяться в воде основания, как и соли, бывают растворимые, малорастворимые и нерастворимые. Преобладают нерастворимые. Среди хорошо растворимых — гидроксид натрия, гидроксид калия. Их растворы мылкие на ощупь.
Растворимые в воде основания получили название щелочи. По таблице растворимости солей, оснований и кислот можно узнать, к какой группе по способности растворяться в воде принадлежит то или иное основание.
Итак, по физической характеристике — способности растворяться в воде — основания разделяют на растворимые, или щелочи, и нерастворимые.
Существует еще одна классификация оснований — по химическим свойствам. Согласно ей их разделяют на типичные основания и амфотерные гидроксиды. Но об этом речь пойдет позже.
Основания, хорошо растворимые в воде,— тугоплавкие вещества. Основания, нерастворимые в воде, при нагревании разлагаются с выделением воды и образованием оксида.
Итоги:
- Основания — сложные вещества немолекулярного строения, химическая формула которых состоит из одного атома металла и одной или нескольких гидроксильных групп.
- Число одновалентных гидроксильных групп в формуле основания равно валентности металла, поэтому в общем виде формула оснований имеет вид
- Современное название основания состоит из слова гидроксид с добавлением к нему названия металла. Если металл проявляет переменную валентность, то ее указывают после названия металла в скобках.
- При обычных условиях основания находятся в твердом состоянии, часть из них хорошо растворяется в воде. Растворенные в воде основания называются щелочами.
Ионный обмен с кислыми солями.
В реакциях ионного обмена могут участвовать кислые соли. Здесь возникает вопрос в правильном написании ионов кислой соли. Впрочем, правила достаточно просты. Если кислая соль образована слабой кислотой (H2S, H2CO3) или кислотой средней силы (H2SO3, H3PO4), то анион кислой соли мы записываем вместе с водородом, исключая его дальнейшую диссоциацию на катион водорода и анион средней соли. То есть распад на ионы запишется так:
NaHS ⇆ Na+ + HS-KHCO3 ⇆ K+ + HCO3-NaHSO3 ⇆ Na+ + HSO3-Na2HPO4 ⇆ 2Na+ + HPO42-NaH2PO4 ⇆ Na+ + H2PO4—
В том случае, если кислая соль образована сильной кислотой, то, строго говоря, такой кислый анион может диссоциировать дальше на катион водорода и анион средней соли. Тем не менее современные требования к ЕГЭ по химии разрешают в ионных уравнениях писать как кислый, так и средний анион. Для гидросульфата натрия два этих варианта выглядят так:
NaHSO4 ⇆ Na+ + HSO4-NaHSO4 ⇆ Na+ + H+ + SO4—
Теперь можно посмотреть, в какие именно реакции ионного обмена вступают кислые соли. Прежде всего это, конечно, нейтрализация. Кислые соли легко реагируют с щелочами, превращаясь в средние соли. Приведем пример.
KHCO3 + KOH → K2CO3 + H2O (молекулярная форма)
Запишем полное ионное уравнение, помня о сказанном выше.
K+ + HCO3— + K+ + OH- → 2K+ + CO32- + H2O (полная ионная форма)
Сократим повторяющиеся ионы и получим краткое ионное уравнение:
K+ + HCO3— + K+ + OH- → 2K+ + CO32- + H2O (полная ионная форма)
HCO3— + OH- → CO32- + H2O (краткая ионная форма)
Если взять дигидрофосфат, то его можно нейтрализовать частично с превращением с гидрофосфат и можно нейтрализовать полностью с превращением в средний фосфат. То, как пойдет реакция, зависит от мольного соотношения щелочи и дигидрофосфата. Если взят избыток щелочи, то нейтрализация будет полной, его недостаток, то нет. Ниже показаны оба случая.
NaH2PO4 + NaOH (недостаток) → Na2HPO4 + H2O (молекулярная форма)
Na+ + H2PO4— + Na+ + OH- → 2Na+ + HPO42- + H2O (полная ионная форма)
H2PO4— + OH- → HPO42- + H2O (краткая ионная форма)
NaH2PO4 + 2NaOH (избыток) → Na3PO4 + 2H2O (молекулярная форма)
Na+ + H2PO4— + 2Na+ + 2OH- → 3Na+ + PO43- + 2H2O (полная ионная форма)
H2PO4— + 2OH- → PO43- + 2H2O (краткая ионная форма)
Есть еще одна ситуация, когда соотношение щелочи и кислоты влияет на то, как протекает реакция. Речь идет о том случае, когда катионы в кислой соли и щелочи разные. Рассмотрим взаимодействие гидрокарбоната калия с гидроксидом бария, взятым в недостатке.
2KHCO3 + Ba(OH)2 (недостаток) → K2CO3 + BaCO3↓ + 2H2O (молекулярная форма)
2K+ + 2HCO3— + Ba2+ + 2OH- → 2K+ + CO32- + BaCO3↓ + 2H2O (полная ионная форма)
2HCO3— + Ba2+ + 2OH- → CO32- + BaCO3↓ + 2H2O (краткая ионная форма)
Здесь происходит обычная нейтрализация гидрокарбоната калия, завершающаяся его превращением в средний карбонат. Катион бария при этом тоже связывается с карбонат-ионом в осадок соли.
Однако если взять избыток гидроксида бария, то образующийся на первом этапе растворимый карбонат калия может с ним прореагировать:
K2CO3 + Ba(OH)2 → 2KOH + BaCO3↓
Тогда суммарно в избытке гидроксида бария реакция запишется так:
KHCO3 + Ba(OH)2 (избыток) → KOH + BaCO3↓ + H2O (молекулярная форма)
K+ + HCO3— + Ba2+ + 2OH- → K+ + OH- + BaCO3↓ + H2O (полное ионное уравнение)
HCO3— + Ba2+ + OH- → BaCO3↓ + H2O (краткое ионное уравнение)
Важно понимать, что продукты реакции в избытке гидроксида могут измениться только в том случае, если с этим гидроксидом может реагировать средняя соль, образующая на первом этапе при его недостатке. Поэтому реакция Ba(HCO3)2 с KOH в избытке щелочи протекает так же, как и при его недостатке
Это связано с тем, что продукт нейтрализации Ва(HCO3)2, образующийся на первом этапе, а именно средняя соль BaCO3 является осадком и далее с КОН не реагирует. А значит, мы в любом случае получим следующие уравнения:
Ba(HCO3)2 + 2KOH → BaCO3↓ + K2CO3 + 2H2O (молекулярная форма)
Ba2+ + 2HCO3— + 2K+ + 2OH- → BaCO3↓ + 2K+ + CO32- + 2H2O (полное ионное уравнение)
Ba2+ + 2HCO3— + 2OH- → BaCO3↓ + CO32- + 2H2O (краткое ионное уравнение)
Также кислые соли, образованные слабыми кислотами, могут вступать в реакции с сильными кислотами. В этом случае слабая кислота вытесняется из своей кислой соли в индивидуальном виде. Ниже приведен пример:
И в заключении этого раздела приведем пример с участием кислой соли сильной кислоты. Это взаимодействие ацетата бария и гидросульфата калия.
Ba(CH3COO)2 + KHSO4 → BaSO4↓ + CH3COOK + CH3COOH (молекулярная форма)
Ba2+ + 2CH3COO- + K+ + HSO4— → BaSO4↓ + CH3COO- + K+ + CH3COOH (полная ионная форма)
Ba2+ + CH3COO- + HSO4— → BaSO4↓ + CH3COOH (краткая ионная форма)
Напомним, что в ионных уравнениях допустимо писать вместо иона HSO4— сумму ионов H+ и SO42-.
Соли и их свойства
Этот класс веществ состоит из частичек кислоты – кислотного остатка и основания – катионов металла (либо иона аммония NH4+). Диссоциация солей всегда идёт в одну стадию.
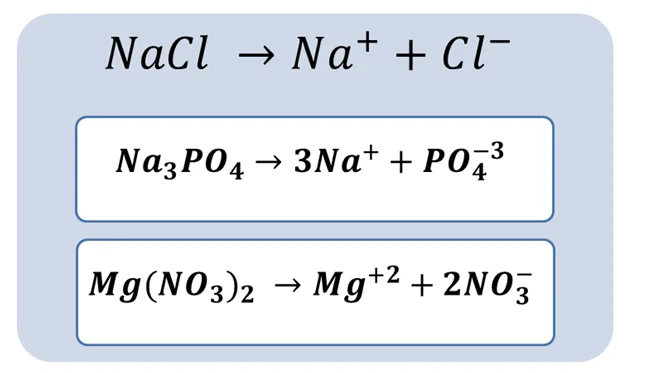
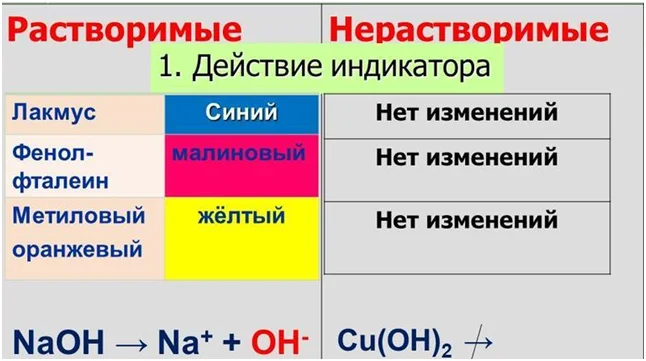
Если посмотреть на состав соли, то смело можно предположить, что их растворы будут нейтральными. Поскольку нет ионов, которые отвечают за реакцию среды. Однако на деле совсем не так. Лакмус в водном растворе солей может иметь как красную, так и синюю окраску, а также не изменять её. Объяснением этого явления служит их взаимодействие с водой, которое имеет название гидролиз солей. Возьмём, к примеру, три пробирки, в которых содержатся растворы NaCl, ZnCl2 и Na2CO3. И в каждую добавим лакмус. Результаты эксперимента отображены на рисунке.
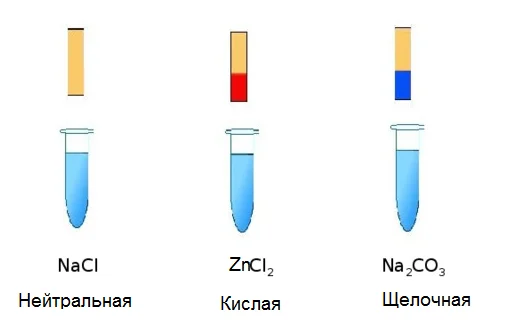
Запишем суть реакции соли с водой (молекулу Н2О распишем как НОН), с помощью ионно-молекулярных уравнений.
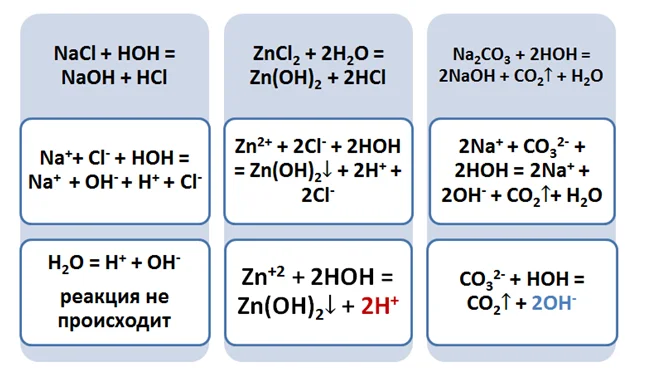
Сокращённое уравнение хорошо иллюстрирует, почему происходит изменение окраски индикатора. Теперь давайте разберёмся, какие соли подвергаются гидролизу.
Именно наличием ионов Н+ в растворе соли ZnCl2, а также группы ОН- в солевом растворе карбоната натрия, объясняется изменение окраски индикатора.
Рассмотрим взаимодействие металлов с солями. Чтобы понять принцип их взаимодействия, вспомним ряд активностей металлов.

Данный вид взаимодействия Вы можете наблюдать, выполнив дома опыт (не забываем о разрешении родителей). Вам понадобится раствор медного купороса и скрепка, либо гвоздь.

На поверхности гвоздя выделилась медь в чистом виде. Это окислительно-восстановительная реакция.
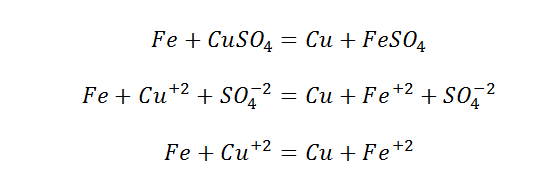
Более сильный металл, вытесняет слабый с раствора его соли. Если промоделировать обратную реакцию, а именно положить медную проволоку в раствор соли железа, то не будет никакого взаимодействия. «Силы» у меди не хватит, потеснить железо.
Взаимодействие солей между собой возможно только, если реагенты растворимы, а в продукте будет осадок.
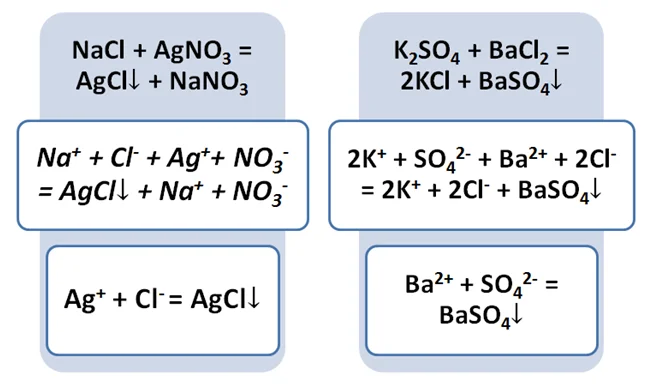
Свойства солей, кислот и оснований, рассмотренных выше, можно объединить в схематическом виде.
Основания и их свойства
Данный класс веществ характеризуется наличием функциональной группы, которая отвечает за химические свойства, а именно группы ОН-. По растворимости основания делятся на щёлочи (растворимые) и нерастворимые основания. Соответственно они будут отличаться по химическим свойствам. Щелочная среда образуется, если есть свободные ОН-, которые образуются при диссоциации щелочей.
Для щелочей, подобно многоосновным кислотам, характерна ступенчатая диссоциация.
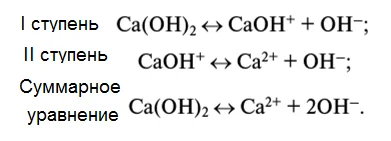
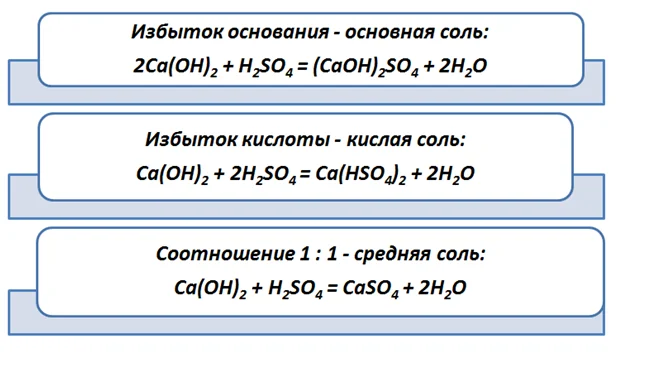
Тем не менее, будет происходить не только взаимодействие щелочей с кислотами, но и нерастворимых оснований. Объяснением этому служит, то, что кислоты практически все растворимы, за исключением силикатной H2SiO3, которая реагирует только со щелочами. Продуктом будет соль (в зависимости от соотношения реагентов средняя, основная или кислая) и вода.
Кислотные оксиды со щелочами образуют соль и воду.
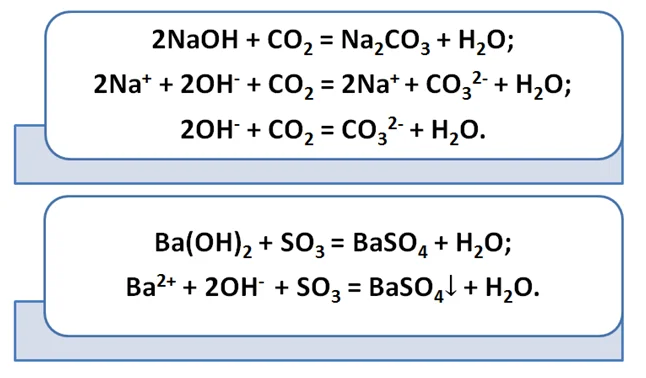
Для нерастворимых оснований эта реакция не характерна, поскольку именно гидроксильная группа реагирует с оксидами.
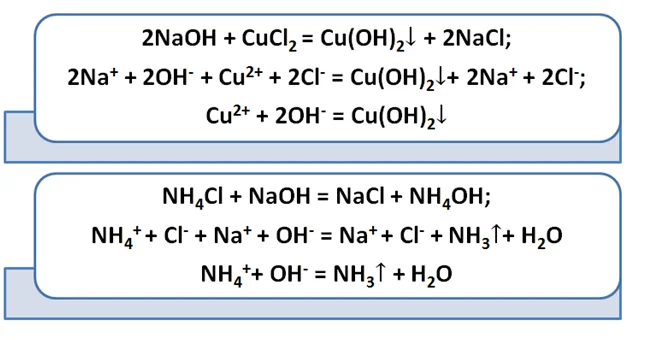
Амфотерные основания реагируют также с щелочами. Результатом данного взаимодействия будет соль, зачастую комплексная, и вода.

Взаимодействие солей с щелочами приводит к образованию соли либо основания. Также не забываем об условии, что в продукте должен быть либо газ, либо осадок.
Отличительной способностью обладают нерастворимые, а также амфотерные основания. Они при нагревании распадаются на оксиды.
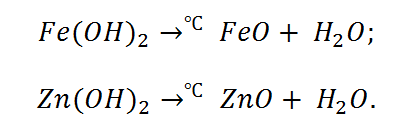
Химия — это просто
- Популярно о химии
-
· Что такое химия
· Периодическая таблица - ОБЩАЯ ХИМИЯ
- Вещества и смеси
-
· Понятие вещества
· Вещество и его состояния
· Простые и сложные вещества
· Чистые вещества и смеси
· Свойства вещества
· Энергия вещества
· Газы
· Растворы
· Коллоидные растворы
· Состав растворов
· Электролитическая диссоциация
· Уравнение ионных реакций
· Степень диссоциации
· Диссоциация кислот и оснований
· Диссоциация воды
· Твердые вещества
· Неорганические вещества
· Оксиды
· Основания
· Кислоты
· Соли
· Гидролиз солей
· Электролиз - Атомы и молекулы
- Строение веществ
- Взаимодействие веществ
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- ОРГАНИЧЕСКАЯ ХИМИЯ