Электроотрицательность
Электроотрицательность — это способность атома оттягивать на себя электроны с внешнего электронного слоя.
Да-да, ЕГЭ вы сдали хорошо — электроотрицательность увеличивается слева направо и сверху вниз, но почему? Выделим две причины, но для второй нам потребуется немного физики. Ну все, ты закрываешь статью и говоришь: «Какая физика?»
- Чем меньше электронов нужно принять для завершения слоя, тем проще их присоединить, так как они будут меньше отталкивать друг друга. Одноименные заряды отталкиваются. Зачем я это написал, ты ведь и так это знаешь…
- Сила притяжения электрона к ядру и радиус атома. Радиус атома в одном периоде плюс-минус одинаковый, но вот сила притяжения электрона к ядру слева направо увеличивается. Мы построим небольшую модельку. Пусть она и не совсем верная, но даст понимание вещей.
Так, начнем с закона Кулона — он показывает силу взаимодействия между двумя электрическими зарядами. Наши заряды разноименные. Атомный остов — положительный, а электрон — отрицательный. Значит они притягиваются друг к другу.
Закон Кулона
Сразу скажу, что ничего считать мы не будем. Коэффициент — k нас не интересует. Нам просто нужно понять, что чем больше q1 и q2, тем больше сила притяжения между зарядами. Радиус, как я писал до этого, примерно одинаковый в одном периоде. Теперь мы можем сравнить электроотрицательность атомов второго периода с помощью небольшого рисунка. Для этого мы предположим, что электроны находятся примерно на одном расстоянии атомного остова.
Электроотрицательность и закон Кулона
Получается, что q1 — это заряд атомного остова, а q2 — заряд электрона, который всегда одинаковый. Вот мы и нашли легкую зависимость — чем больше заряд атомного остова, тем с большей силой он притягивает электрон, и тем больше электроотрицательность. У кислорода заряд ядерного остова 6, а у азота только 5. Самый большой заряд у фтора — 7. С увеличением периода возрастает радиус атома — электроотрицательность становится меньше. Получается, что максимальная электроотрицательность у элементов второго периода и растет она слева направо, так как увеличивается заряд атомного остова.. Хоть мы это и знали, но прикольно же понять почему такое происходит?
Примеры образования ионной связи
Можно привести несколько примеров образования ионной связи:
взаимодействие кальция и фтора
Ca (атом) -2e=Ca2+ (ион)
– кальцию легче отдать два электрона, чем получить недостающие.
F (атом)+1е= F- (ион)
– фтору, наоборот, легче принять один электрон, чем отдать семь электронов.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2. Определим число атомов фтора, которые примут два электрона от атома кальция: 2 : 1 = 2. 4.
Составим формулу ионной химической связи:
Ca+2F →Ca2+F−2.
взаимодействие натрия и кислорода
Na (атом)-1e=Na+ (ион)
– натрий находится в главной подгруппе первой группы. Он с легкостью может отдавать один электрон.
O (атом)+2e=O2– (ион)
– кислород находится в главной подгруппе шестой группы. Естественно, что ему легче получить два электрона, чем отдать шесть.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2 : 1 = 2. Определим число атомов натрия, которые отдадут два электрона атому кислорода: 2. 4.
Составим схему образования ионной связи:
2Na +O →Na+2O2−.
Что мы узнали?
Ионная связь и ионы изучаются в 11 классе. Ионная химическая связь – связь между положительными и отрицательными ионами, осуществляемая между металлами и неметаллами.
-
/10
Вопрос 1 из 10
Сходства и отличия металлической химической связи от ионной и ковалентной
Все виды связи переплетаются между собой и имеют сходные черты. Более того, некоторые соединения могут иметь сразу несколько видов связи в одной молекуле.
Металлическая связь сходна с ионной тем, что атомы металлов в соединениях легко отдают свои валентные электроны, которые слабо связаны со своими атомными ядрами. Отрыв электронов от ядра приводит к формированию катионов металлов.
Обобществление отрицательно заряженных электронов по системе частично перекрывающихся орбиталей металлов приводит к формированию прочной химической связи, что напоминает по механизму образования ковалентную связь.
Каждый из видов связи имеет свои особенности построения решеток, взаимодействия частиц, а также характерные свойства.
Несмотря на схожесть металлической связи с ковалентной и ионной, каждая из них имеет ряд характерных черт, благодаря которым можно легко определить вид связи в соединении.
Металлическая связь в отличие от ковалентной имеет высокую концентрацию электронов проводимости в атомах металлов. Она менее прочна, чем ковалентная, а ее энергия связей меньше в 3-4 раза.
В отличие от ковалентной связи металлическая:
- ненасыщаема — объединяет большое количество атомов;
- ненаправлена и делокализирована и электроны в связи обобществляются всеми атомами соединения.
В отличие от ионной связи металлическая образуется между катионами и отрицательно заряженными электронами, которые не привязаны к одному атомному ядру, а свободно движутся по кристаллической решетке.
3.1. Теория химического строения
Крупным шагом в развитии представлений о строении
молекул явилась теория химического строения, выдвинутая в 1861 г.
выдающимся русским химиком А. М. Бутлеровым.
Основу теории, разработанной А. М. Бутлеровым,
составляют следующие положения:
¨Атомы в молекулах соединены друг с другом в определенной
последовательности. Изменение этой последовательности приводит к
образованию нового вещества с новыми свойствами.
¨Соединение атомов происходит в соответствии с их
валентностью.
¨Свойства веществ зависят не только от их состава, но и от
их «химического строения», т. е. от порядка соединения атомов в
молекулах и характера их взаимного влияния. Наиболее сильно влияют друг
на друга атомы, непосредственно связанные между собой.
Таким образом, согласно теории Бутлерова свойства
веществ определяются не только их качественным и количественным
составом, но и внутренней структурой молекул, определенным порядком
соединения между собой атомов, образующих молекулу. Эту внутреннюю
структуру Бутлеров называл «химическим строением»
Особенно важной была
идея Бутлерова о том, что атомы, соединяясь в определенной
последовательности в соответствии с их валентностью, взаимно влияют друг
на друга таким образом, что частично изменяется их собственная природа,
их «химическое содержание». Так, свойства атома водорода существенно
меняются в зависимости от того, соединен ли он с атомом хлора (в
молекуле НСl), кислорода (в молекуле
H2O) или
азота (в молекуле NН3)
Теория Бутлерова дает возможность изображать
строение молекул в виде структурных формул, в которых указана
последовательность соединения атомов друг с другом, а каждая черточка,
соединяющая атомы, обозначает единицу валентности. Так, строение молекул
хлористого водорода (НСl), хлорноватистой (НСlO)
и хлорноватой (НClO3) кислот
выражается следующими структурными формулами:
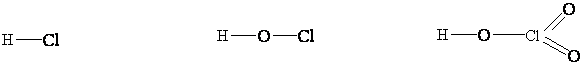
Эти формулы прежде всего показывают, что только в
молекуле НСl атом водорода непосредственно
связан с атомом хлора, тогда как в молекулах НСlO
и НClO3 он соединен не с хлором, а
с атомом кислорода. Кроме того, структурная формула хлорноватой кислоты
указывает на неравноценность атомов кислорода; в ее молекуле каждый из
двух атомов кислорода соединен с атомом хлора двумя валентными связями,
а третий связан одновременно с атомами хлора и водорода.
Структурные формулы позволяют понять причину
различий в некоторых свойствах ортофосфорной (Н3РО4),
фосфористой (Н3РО3) и фосфорноватистой (Н3РО2)
кислот. Молекулы каждой из этих кислот содержат по три атома водорода.
Приведем их структурные формулы:
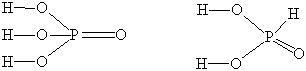
Как видно, в молекуле ортофосфорной кислоты каждый
атом водорода соединен с атомом кислорода. Все эти атомы водорода
способны замещаться атомами металлов: поэтому Н3РO4
трехосновна. В молекуле фосфористой кислоты только два атома водорода
непосредственно связаны с атомами кислорода и способны замещаться
атомами металлов: эта кислота двухосновна. В молекуле же
фосфорноватистой кислоты с атомом кислорода связан лишь один атом
водорода, что и обусловливает ее одноосновность
Изображение химического
строения молекул с помощью структурных формул особенно важно при
изучении органических веществ
![]()
Структурные формулы отражают лишь
последовательность соединения атомов друг с другом, а не взаимное
расположение атомов в пространстве. Изображение химического строения с
помощью структурных формул допустимо только для веществ, состоящих из
молекул. Между тем многие вещества состоят не из молекул, а из атомов
(например карбид кремния SiC) или имеют ионное
строение (например хлорид натрия NaCl).
Структура подобных веществ определяется типом их кристаллической решетки
и будет подробнее рассмотрена в гл. 6.
3.4. Направленность ковалентной связи
Свойства молекулы, ее способность вступать в
химическое взаимодействие с другими молекулами зависят не только от
прочности химических связей в молекуле, но в значительной мере и от ее
пространственного строения. Раздел химии, изучающий геометрическую
структуру молекул, их пространственное строение, называется
стереохимией. Выше уже говорилось, что образование ковалентной связи
является результатом перекрывания валентных электронных облаков
взаимодействующих атомов. Но такое перекрывание возможно только при
определенной взаимной ориентации электронных облаков; при этом область
перекрывания располагается в определенном направлении по отношению к
взаимодействующим атомам. Иначе говоря, ковалентная связь обладает
направленностью.
Так, в молекуле водорода перекрывание атомных s-электронных
облаков происходит вблизи прямой, соединяющей ядра взаимодействующих
атомов. Образованная подобным образом ковалентная связь называется σ-связью
(сигма-связь).
В образовании σ-связи могут принимать участие и
р-электронные облака, ориентированные вдоль оси связи. Так, в
молекуле HF (рис. 3.4, а) ковалентная σ-связь
возникает вследствие перекрывания 1s-электронного облака атома
водорода и 2p-электронного облака атома
фтора. Химическая связь в молекуле F2
(рис. 3.4, б) тоже σ-связь; она образована 2р-электронными
облаками двух атомов фтора.
При взаимодействии p-электронных
облаков, ориентированных перпендикулярно оси связи (рис. 3.5),
образуется не одна, а две области перекрывания, расположенные по обе
стороны от этой оси. Такая ковалентная связь называется
π-cвязью.
|
|
|
| а | б |
Рис.
3.4. Схемы перекрывания электронных облаков при образовании молекул: а –
HF, б – F2
Рис.
3.5. Схемы перекрывания p-электронных облаков
при образовании π-cвязи
Рассмотрим образование молекулы азота
N2. Каждый атом азота обладает
тремя неспаренными 2p-электронами,
электронные облака которых ориентированы в трех взаимно перпендикулярных
направлениях.
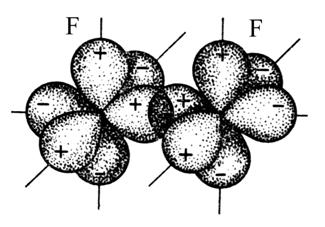
На рис. 3.6 изображено перекрывание р-электронных
облаков в молекуле N2 (для удобства изображения перекрывание
рх-, ру— и рz-облаков
показано раздельно). Атомы азота связаны в молекуле N2
тремя ковалентными связями. Но эти связи неравноценны: одна из них σ-связь,
а две другие π-связи. Вывод о неравноценности связей в молекуле азота
подтверждается тем, что энергия их разрыва различна.
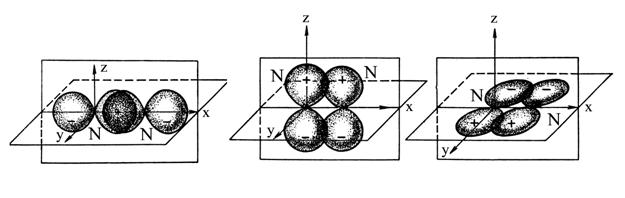
Рис.
3.6. Схемы перекрывания 2p-электронных облаков
в молекуле N2: а – σ-cвязь,
б,в — π-cвязи
Представление о направленности ковалентных связей
позволяет объяснить взаимное расположение атомов в многоатомных
молекулах. Так, при образовании молекулы воды электронные облака двух
неспаренных 2p-электронов атома
кислорода перекрываются с 1s-электронными облаками двух атомов
водорода; схема этого перекрывания изображена на рис. 3.7, а. Поскольку
р-электронные облака атома кислорода ориентированы во взаимно
перпендикулярных направлениях, то молекула Н2О имеет, как
показано на рис. 3.7, а, угловое строение, причем можно ожидать, что
угол между связями О—Н будет составлять 90°.
Молекула NH3,
образующаяся при взаимодействии трех р-электронов атома азота с
s-электронами трех атомов водорода (рис. 3.7, б), имеет структуру
пирамиды, в вершине которой находится атом азота, а в вершинах основания
— атомы водорода. И в этом случае можно ожидать, что углы между связями
N—Н будут равны 90°.
Эти выводы о взаимном расположении атомов в
молекулах NH3 и Н2О
соответствуют действительности. Однако углы между связями (валентные
углы) отличаются от 90°: в молекуле воды угол НОН составляет 104,5°, а в
молекуле аммиака угол HNH равен 107,3°
Для
объяснения отличия валентных углов в молекулах от 90° следует принять во
внимание, что устойчивому состоянию молекулы отвечают такая ее
геометрическая структура и такое пространственное расположение
электронных облаков внешних оболочек атомов, которым отвечает наименьшая
потенциальная энергия молекулы
Рис.
3.7. Схемы образования химических связей в молекулах: а – воды, б –
аммиака
Это приводит к тому, что при образовании молекулы
формы и взаимное расположение атомных электронных облаков изменяются по
сравнению с их формами и взаимным расположением в свободных атомах. В
результате достигается более полное перекрывание валентных электронных
облаков и, следовательно, образование более прочных ковалентных связей.
В рамках метода валентных связей такая перестройка электронной структуры
атома рассматривается на основе представления о гибридизации атомных
орбиталей.
Химическая связь — понятие, природа явления
В конце XVIII века Уильям Хиггинс опубликовал научную работу, в которой описал предположение о существовании неких связей между частицами всех веществ. Эта теория стала предвестником теории о валентности, которая на тот момент воспринималась как «соединительная сила» веществ.
Такие представления существовали в мире химии до открытия электрона. С момента возникновения теории о химических связях понятие валентности было вытеснено из научного толкования, а сам термин стал претерпевать значительные изменения.
Теория химических связей смогла более точно объяснить связь частиц тех веществ, с которыми сталкивался человек. Определение химической связи звучит следующим образом:
Благодаря стремлению веществ к более стабильным и устойчивым состояниям с минимальным расходом энергии появляются различные химические соединения.
Основными характеристиками химической связи являются:
- прочность;
- длина;
- полярность.
Процесс образования химических связей не может происходить бесследно для вещества. Он всегда сопровождается выделением энергии химической связи.
Большую роль в процессе формирования химической связи играют валентные электроны, находящиеся на внешнем энергетическом уровне (электронном слое) атома. Они вступают во взаимодействие с другими атомами, образуя новые химические соединения.
Способность притягивать электроны — электроотрицательность — играет важную роль при образовании химической связи и определяет ее вид. По правилу октета завершенным считается внешний энергетический уровень, содержащий 8 электронов у большинства веществ и 2 электрона у гелия.
Современная химия различает несколько видов связей:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова.
Основные теории и представления
До открытия электрона представления о химической связи заключались в теории валентности — способности атомов образовывать химические связи в определенном количестве, ограниченном числом неспаренных электронов.
Точное и полное понимание теории сложилось к 1852 году, когда свой труд о соединительной силе атомов опубликовал химик Эдуард Франкленд. Он переосмыслил все знания о валентности, существовавшие до него и объединил их в одну теорию, согласно которой появилось учение о валентности.
В 1861 году в теорию внес свой вклад А. М. Бутлеров, который показал четкое различие между изолированным и входящим в состав соединение атомом. Эти знания позволили получить наглядное изображение атома в виде первых молекулярных моделей.
Дальнейшие основные теории химической связи делятся на:
- электронные;
- квантовые.
К электронным теориям относятся электронная теория химической связи и Боровская модель.
Электронная теория сформировалась в 1912-16 годах американским физиком и химиком Г. Н. Льюисом. Она стала основой классической теории строения в органической части химических исследований. Согласно этой теории атомы, вступающие в связь при ковалентном соединении, имеют общую электронную плотность, которая делится между ними.
Это мнение шло в противовес господствовавшей тогда теории о положительном и отрицательном заряде атомов, которые несут разные атомы. Также концепция Льюиса включала формулирование правило октета.
Боровская модель была опубликована в 1913 году Нильсом Бором в статье «Системы, содержащие несколько ядер». Согласно модели, электроны атомов образовывают кольцо, которое вращается перпендикулярно оси молекулы. Однако эта система требовала усовершенствования и доработки, а все попытки их осуществления приводили к неудачам.
Квантовые теории химической связи включают в себя теорию валентных связей и теорию молекулярных орбиталей.
В 1927 году В. Гайтлером и Ф. Лондоном была заложена теория валентных связей, основанная на том, что каждая пара атомов в молекуле удерживается при помощи общих электронных пар.
Молекулу как целый объект рассматривает теория молекулярных орбиталей. Согласно ей молекула является сложной системой, и поэтому должна рассматриваться как целое и не разбиваться при исследованиях на более мелкие частицы, иначе они теряют свои свойства. Данная теория описывает свойства отдельных молекул и дает понимание о распределении плотности вероятности обнаружения электрона в заданном пространстве.
Общая характеристика ионной химической связи
Ионы – это частицы, имеющие заряд, в которые превращаются атомы в процессе отдачи или принятия электронов. Притягиваются они друг к другу довольно сильно, именно по этой причине у веществ с таким типом связи высокие температуры кипения и плавления.
Рис. 1. Ионы.
Ионная связь – химическая связь между разноименными ионами, обусловленная их электростатическим притяжением. Ее можно считать предельным случаем ковалентной связи, когда разность электроотрицательностей связанных атомов так велика, что происходит полное разделение зарядов.
Рис. 2. Ионная химическая связь.
Обычно считается, что связь приобретает электронный характер, если ЭО >1,7.
Различие в значении электроотрицательности тем больше, чем дальше элементы расположены друг от друга в периодической системе по периоду. Эта связь характерна для металлов и неметаллов, особенно расположенных в наиболее удаленных группах, например, I и VII.
Пример: поваренная соль, хлорид натрия NaCl:
Рис. 3. Схема ионной химической связи хлорида натрия.
Ионная связь существует в кристаллах, она обладает прочностью, длиной, но не насыщена и не направлена. Ионная связь характерна только для сложных веществ, таких как соли, щелочи, некоторые оксиды металлов. В газообразном состоянии такие вещества существуют в виде ионных молекул.
Ионная химическая связь образуется между типичными металлами и неметаллами. Электроны в обязательном порядке от металла переходят к неметаллу, образуя ионы. В результате образуется электростатическое притяжение, которое называют ионной связью.
На самом деле полностью ионной связи не встречается. Так называемая ионная связь носит частично ионный, частично ковалентный характер. Однако связь сложных молекулярных ионов может считаться ионной.
Виды химической связи
Ионная химическая связь
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностьюэлектроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью.
Результатом этого является образование соединения противоположно заряженных ионов:
Это притяжение ионов как разноимённо заряженных тел. Ионная связь — крайний случай поляризации ковалентной полярной связи.
Образуется между типичными металлом и неметаллом (Me + неМе).
При этом электроны у металла полностью переходят к неметаллу, образуются ионы (частицы, имеющие заряд).
Например, типичные металлы литий (Li), натрий (Na), калий (K), кальций (Ca), стронций (Sr), барий (Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия (NaOH) и сульфате натрия (Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи — ковалентные полярные).
Ковалентная химическая связь
Ковалентная полярная химическая связь образуется при взаимодействии атомов, значение электроотрицательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому.
Электроотрицательность (ЭО) — способность атома химических элемента смещать к себе общие электронные пары, участвующие в образовании химической связи.
Ковалентная полярная связь образуется между разными неметаллами (неМе + неMe).
Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
Такая связь существует в молекулах следующих сложных веществ: Н2О, H2S, NH3 и др.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония (Н3О+) и аммония (NH4+).
Металлическая химическая связь
Связь в металлах и сплавах между атом-ионами посредством обобществленных электронов называется металлической.
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
Металлическая химическая связь образуется в простых веществах-металлах (Me).
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь, т.е. электроны как бы цементируют положительные ионы кристаллической решетки металлов.
Металлическая связь существует в металлах в твердом в жидком состоянии. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3 электрона) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу.
В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные ионы, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ» , обеспечивающий связь между атомами металла.
Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью.
Металлическая связь возникает за счет обобществления атомами валентных электронов. Однако между этими видами связи есть существенное различие. Электроны, осуществляющие ковалентную связь, в основном пребывают в непосредственной близости от двух соединенных атомов.
В случае металлической связи электроны, осуществляющие связь, перемещаются по всему куску металла. Этим определяются общие признаки металлов: металлический блеск, хорошая проводимость теплоты и электричества, ковкость, пластичность и т. д.
Общим химическим свойством металлов является их относительно высокая восстановительная способность.
Значимость изучения типов химических связей
На сегодняшний день химия — одна из ведущих наук. На балансе передовых химиков десятки, сотни, тысячи достижений и прорывов, которые значительно упростили условия жизни человека, сделали их более комфортными, а в некоторых случаях — подарили возможность жить. Без химии современная жизнь просто бессмысленна. Ведь посмотрите только по сторонам — по сути все, что нас окружает — продукты химической промышленности
Помимо этого, важность изучения химической науки помогает повысить общую эрудицию и лучше познать себя и окружающий мир. Чем больше человек знает, тем больше стремится к дальнейшему познанию
Именно типология химических связей — одна из ключевых тем данной дисциплины, именно поэтому тему стоит освоить детально и старательно.