Понятие водных кластеров

Земля — чемпион по содержанию воды среди других планет Солнечной системы. Моря и океаны, реки и озёра, средние глубины которых достигают 6 тыс. метров, занимают 70% земной поверхности, а в областях полюсов сосредоточились огромные запасы влаги в виде снегов и льдов.
Трудно переоценить влияние воды на возникновение и существование жизни на нашей планете. Это связано с особенностями, нехарактерными для соединений, считающихся её близкими аналогами. Только вода находится в жидком и твёрдом состоянии при условиях, в которых водородные соединения серы или селена с большей атомной массой становятся газообразными.
Присутствие H-связей в молекулах воды обуславливает образование водных кластеров или комплексов, а димеры воды служат их простейшими примерами. Энергия их водородных связей ненамного больше энергии броуновского движения при нормальных условиях, но сильно отличается от мощности ковалентных связей в гидроксильных группах, а они в 200 раз превышают тепловые показатели. Вода из простой жидкости превращается в сложную, «связанную» сетью H-связей, хотя они относительно слабы и неустойчивы, самопроизвольно возникают и исчезают при температурных изменениях.
Кристаллическая структура льда имеет объёмную сетку из этих связей, и молекулы H2O расположены так, чтобы атомы водорода одних молекул оказывались направленными к атомам кислорода соседей. В ледяном кристалле между молекулами обязательно присутствуют пустоты, их объёмы немного превышают размеры отдельных молекул воды. Именно благодаря таким «карманам» плотность льда меньше, чем у его жидкой фазы, а гигантские айсберги остаются дрейфовать на поверхности, в то время как замерзание большинства других веществ существенно увеличивает их плотность.
Водородные связи сообщают воде уникальную характеристику, обеспечивающую существование разнообразных форм жизни в областях, где окружающие температуры опускаются ниже нуля. Если на минуту представить, что лёд начнёт тонуть в воде, то моря зимой рано или поздно промёрзнут до самого дна, и рыбы будут обречены на вымирание. Люди могли бы растапливать лёд для получения живительной влаги, но это потребует больших энергозатрат.

Ещё одно проявление H-связей — голубая окраска чистой воды в её толще. Колебание одной молекулы воды вызывает движение соседних частиц, соединенных с ней водородными связями. Красные лучи из состава солнечного спектра будут расходоваться на поддержание этих колебаний, поскольку больше всего соответствуют им энергетически. Происходит фильтрация красных лучей — их энергия поглощается и рассеивается в виде тепла колеблющимися молекулами.
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом. Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”. Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Внутримолекулярные взаимодействия
Определение 1
Под внутримолекулярным взаимодействием понимают различные виды химической связи, обеспечивающие существование многоатомных соединений (ионов, молекул, кристаллических веществ и др.). Химическая связь — это физико — химическое явление взаимодействия атомов, при котором перекрываются электронные облака связывающихся частиц и уменьшается энергия системы. Химическая связь представляет собой силу, которая удерживает атомы вместе и позволяет им функционировать вместе как единой группе.
Стабильность группы атомов, объединённых химической связью, определяется тем, насколько удалось понизить энергию по сравнению с отдельными атомами. Чем больше при образовании химической связи выделяется энергии, тем прочнее связь.
Получи помощь с рефератом от ИИ-шки
ИИ ответит за 2 минуты
Энергетический уровень многоатомной системы определяется балансом сил отталкивания между одинаково заряженными частицами и сил притяжения между частицами с зарядами разного знака.
Наибольший вклад в образование химической связи вносят электроны внешних оболочек атомов.
Химическая связь характеризуется:
-
снижением общей энергии системы по сравнению с суммарной энергией изолированных частиц, образующих эту систему;
-
перераспределением электронных плотностей в местах образования химических связей;
-
взаимодействием между положительно заряженными ядрами атомов и отрицательно заряженными электронами.
Методы описания связей
Известно несколько способов описания:
- Метод валентных связей, сокращенно МВС, или теория локализованных электронных пар. Второе название связано с тем, что химическая связь между атомами происходит за счет одной или нескольких электронных пар, располагающихся между ними. Число этих связей определяется валентностью атома. Простейшая химическая связь в МВС всегда двухатомная и двухцентровая, осуществляется за счет валентных электронов.
- Метод молекулярных орбиталей, сокращенно ММО. Этот метод построен на предположении, что состояние электронов в молекуле можно описать как совокупность молекулярных электронных облаков (орбиталей). Для получения молекулярных орбиталей необходимо, чтобы атомные орбитали имели примерно равные энергии, заметно перекрывались и обладали одинаковой симметрией относительно образуемой химической связи.
4.2. Энергия связи
Энергия связи – это энергия, которая выделяется при
образовании молекулы из одиночных атомов. Энергия связи отличается от ΔHобр.
Теплота образования – это энергия, которая выделяется или поглощается
при образовании молекул из простых веществ. Так:
N2 + O2 →2NO + 677,8 кДж/моль – ∆Hобр.
N + O →
NO — 89,96 кДж/моль – Е
св.
Для
двухатомных молекул энергия связей равна энергии диссоциации, взятой с
обратным знаком: например в молекуле F2 энергия связи между
атомами F-F равна — 150,6 кДж/моль.
Для многоатомных молекул с одним типом связи,
например, для молекул АВn, средняя энергия связи равна 1/n
части полной энергии образования соединения из атомов. Так, энергия
образования СН4 = -1661,1 кДж/моль. Так как в молекуле СН4
четыре связи, то энергия одной связи С – Н равна 415,3 кДж/моль.
Исследование большого числа известных в настоящее время данных по
энергиям связи показывает, что энергия связи между конкретной парой
атомов часто оказывается величиной постоянной при условии, что остальная
часть молекулы изменяется незначительно. Так, в насыщенных углеводородах
Есв (C – Н) = 415,3 кДж/моль, Есв
(C – С) = 331,8 кДж/моль.
Энергии связей в молекулах, состоящих из одинаковых
атомов, уменьшаются по группам сверху вниз (табл. 4.1).
По периоду энергии связей растут. В этом же
направлении возрастает и сродство к электрону
Таблица 4.1
Энергии
связей некоторых двухатомных молекул
|
Молекула |
Есв, ккал/моль |
Eсв, кДж/моль |
| H2 | 103 | 430,95 |
| Li2 | 25 | 104,6 |
| Na2 | 17 | 71,1 |
| K2 | 12 | 50,2 |
| Rb2 | 11 | 46,0 |
|
Cs2 |
10 | 41,8 |
| F2 | 36 | 150,6 |
| Cl2 | 57 | 238,5 |
| Br2 | 46 | 192,5 |
| I2 | 36 | 150,6 |
Если в молекуле соединяются более двух различных
атомов, то средняя энергия связи не совпадает с величиной энергии
диссоциации молекулы. Если в молекуле представлены различные типы связи,
то каждому из них можно приближенно приписать определенное значение Е.
Это позволяет оценить энергию образования молекулы из атомов. Например,
энергию образования молекулы пентана из атомов углерода и водорода можно
вычислить по уравнению:
Е = 4EC-C
+ 12EC-H.
В табл. 4.2 рассматривается взаимосвязь между
энергией химической связи и свойствами веществ.
Таблица 4.2
Взаимосвязь между энергией химической связи и
свойствами веществ
|
Вид связи |
Энергия связи, кДж/моль |
Свойства |
|
Ковалентная |
400 |
Высокие твердость, прочность, температуры |
|
Ионная |
250 |
Хрупкость |
|
Металлическая |
150 |
Высокая пластичность |
|
Водородная |
60 |
Низкие твердость, прочность, температуры |
|
Вандерваальсова |
40 |
Способы образования ковалентной связи
Ковалентная химическая связь — это связь, возникающая между атомами за счет образования общих электронных пар.
Ковалентные соединения – обычно газы, жидкости или сравнительно низкоплавкие твердые вещества. Одним из редких исключений является алмаз, который плавится выше 3 500 °С. Это объясняется строением алмаза, который представляет собой сплошную решетку ковалентно связанных атомов углерода, а не совокупность отдельных молекул. Фактически любой кристалл алмаза, независимо от его размера, представляет собой одну огромную молекулу.
Ковалентная связь возникает при объединении электронов двух атомов неметаллов. Возникшая при этом структура называется молекулой.
Механизм образования такой связи может быть обменный и донорно-акцепторный.
В большинстве случаев два ковалентно связанных атома имеют разную электроотрицательность и обобществленные электроны не принадлежат двум атомам в равной степени. Большую часть времени они находятся ближе к одному атому, чем к другому. В молекуле хлороводорода, например, электроны, образующие ковалентную связь, располагаются ближе к атому хлора, поскольку его электроотрицательность выше, чем у водорода. Однако разница в способности притягивать электроны не столь велика, чтобы произошел полный перенос электрона с атома водорода на атом хлора. Поэтому связь между атомами водорода и хлора можно рассматривать как нечто среднее между ионной связью (полный перенос электрона) и неполярной ковалентной связью (симметричное расположение пары электронов между двумя атомами). Частичный заряд на атомах обозначается греческой буквой δ. Такая связь называется полярной ковалентной связью, а о молекуле хлороводорода говорят, что она полярна, т. е. имеет положительно заряженный конец (атом водорода) и отрицательно заряженный конец (атом хлора).
1. Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов.
1) Н2 — водород.
Связь возникает благодаря образованию общей электронной пары s-электронами атомов водорода (перекрыванию s-орбиталей).
2) HCl — хлороводород.
Связь возникает за счет образования общей электронной пары из s- и р-электронов (перекрывания s-р-орбиталей).
3) Cl2: В молекуле хлора ковалентная связь образуется за счет непарных р-электронов (перекрывание р-р-орбиталей).
4) N2: В молекуле азота между атомами образуются три общие электронные пары.
Химическая связь — понятие, природа явления
В конце XVIII века Уильям Хиггинс опубликовал научную работу, в которой описал предположение о существовании неких связей между частицами всех веществ. Эта теория стала предвестником теории о валентности, которая на тот момент воспринималась как «соединительная сила» веществ.
Такие представления существовали в мире химии до открытия электрона. С момента возникновения теории о химических связях понятие валентности было вытеснено из научного толкования, а сам термин стал претерпевать значительные изменения.
Теория химических связей смогла более точно объяснить связь частиц тех веществ, с которыми сталкивался человек. Определение химической связи звучит следующим образом:
Благодаря стремлению веществ к более стабильным и устойчивым состояниям с минимальным расходом энергии появляются различные химические соединения.
Основными характеристиками химической связи являются:
- прочность;
- длина;
- полярность.
Процесс образования химических связей не может происходить бесследно для вещества. Он всегда сопровождается выделением энергии химической связи.
Большую роль в процессе формирования химической связи играют валентные электроны, находящиеся на внешнем энергетическом уровне (электронном слое) атома. Они вступают во взаимодействие с другими атомами, образуя новые химические соединения.
Способность притягивать электроны — электроотрицательность — играет важную роль при образовании химической связи и определяет ее вид. По правилу октета завершенным считается внешний энергетический уровень, содержащий 8 электронов у большинства веществ и 2 электрона у гелия.
Современная химия различает несколько видов связей:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова.
Основные теории и представления
До открытия электрона представления о химической связи заключались в теории валентности — способности атомов образовывать химические связи в определенном количестве, ограниченном числом неспаренных электронов.
Точное и полное понимание теории сложилось к 1852 году, когда свой труд о соединительной силе атомов опубликовал химик Эдуард Франкленд. Он переосмыслил все знания о валентности, существовавшие до него и объединил их в одну теорию, согласно которой появилось учение о валентности.
В 1861 году в теорию внес свой вклад А. М. Бутлеров, который показал четкое различие между изолированным и входящим в состав соединение атомом. Эти знания позволили получить наглядное изображение атома в виде первых молекулярных моделей.
Дальнейшие основные теории химической связи делятся на:
- электронные;
- квантовые.
К электронным теориям относятся электронная теория химической связи и Боровская модель.
Электронная теория сформировалась в 1912-16 годах американским физиком и химиком Г. Н. Льюисом. Она стала основой классической теории строения в органической части химических исследований. Согласно этой теории атомы, вступающие в связь при ковалентном соединении, имеют общую электронную плотность, которая делится между ними.
Это мнение шло в противовес господствовавшей тогда теории о положительном и отрицательном заряде атомов, которые несут разные атомы. Также концепция Льюиса включала формулирование правило октета.
Боровская модель была опубликована в 1913 году Нильсом Бором в статье «Системы, содержащие несколько ядер». Согласно модели, электроны атомов образовывают кольцо, которое вращается перпендикулярно оси молекулы. Однако эта система требовала усовершенствования и доработки, а все попытки их осуществления приводили к неудачам.
Квантовые теории химической связи включают в себя теорию валентных связей и теорию молекулярных орбиталей.
В 1927 году В. Гайтлером и Ф. Лондоном была заложена теория валентных связей, основанная на том, что каждая пара атомов в молекуле удерживается при помощи общих электронных пар.
Молекулу как целый объект рассматривает теория молекулярных орбиталей. Согласно ей молекула является сложной системой, и поэтому должна рассматриваться как целое и не разбиваться при исследованиях на более мелкие частицы, иначе они теряют свои свойства. Данная теория описывает свойства отдельных молекул и дает понимание о распределении плотности вероятности обнаружения электрона в заданном пространстве.
Правило Октета
Электронная конфигурация атома особенно стабильна (иными словами, имеет минимальный запас энергии, что всегда предпочтительно), когда внешняя электронная оболочка заполнена. Поэтому атомы склонны к таким превращениям, в результате которых во внешнем слое оказывается „магическое” число электронов — восемь. Исключение составляют атомы первых двух элементов периодической системы, для которых предпочтительно образование двухэлектронной внешней оболочки.
Модели атомов инертных газов
Правило октета объясняет, почему инертные газы (группа VIIIA) гелий, неон и аргон обычно не вступают в химические реакции. Их внешняя электронная оболочка уже заполнена, следовательно нет необходимости во взаимодействии с другими атомами с целью принять, отдать или объединить электроны.
Элементы 3—7-го периодов также обычно подчиняются правилу октета (т. е. склонны к заполнению s- и р-орбиталей, хотя могут иметься d- и f-орбитали).
Согласно правилу октета большинство атомов склонно принимать, отдавать или объединять электроны с тем, чтобы создать восьмиэлектронную внешнюю оболочку.
Виды химической связи
Ионная химическая связь
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностьюэлектроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью.
Результатом этого является образование соединения противоположно заряженных ионов:
Это притяжение ионов как разноимённо заряженных тел. Ионная связь — крайний случай поляризации ковалентной полярной связи.
Образуется между типичными металлом и неметаллом (Me + неМе).
При этом электроны у металла полностью переходят к неметаллу, образуются ионы (частицы, имеющие заряд).
Например, типичные металлы литий (Li), натрий (Na), калий (K), кальций (Ca), стронций (Sr), барий (Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия (NaOH) и сульфате натрия (Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи — ковалентные полярные).
Ковалентная химическая связь
Ковалентная полярная химическая связь образуется при взаимодействии атомов, значение электроотрицательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому.
Электроотрицательность (ЭО) — способность атома химических элемента смещать к себе общие электронные пары, участвующие в образовании химической связи.
Ковалентная полярная связь образуется между разными неметаллами (неМе + неMe).
Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
Такая связь существует в молекулах следующих сложных веществ: Н2О, H2S, NH3 и др.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония (Н3О+) и аммония (NH4+).
Металлическая химическая связь
Связь в металлах и сплавах между атом-ионами посредством обобществленных электронов называется металлической.
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
Металлическая химическая связь образуется в простых веществах-металлах (Me).
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь, т.е. электроны как бы цементируют положительные ионы кристаллической решетки металлов.
Металлическая связь существует в металлах в твердом в жидком состоянии. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3 электрона) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу.
В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные ионы, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ» , обеспечивающий связь между атомами металла.
Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью.
Металлическая связь возникает за счет обобществления атомами валентных электронов. Однако между этими видами связи есть существенное различие. Электроны, осуществляющие ковалентную связь, в основном пребывают в непосредственной близости от двух соединенных атомов.
В случае металлической связи электроны, осуществляющие связь, перемещаются по всему куску металла. Этим определяются общие признаки металлов: металлический блеск, хорошая проводимость теплоты и электричества, ковкость, пластичность и т. д.
Общим химическим свойством металлов является их относительно высокая восстановительная способность.
Характерные особенности
Этот тип связи возникает в молекулах, когда их атом водорода, поляризованный положительно, взаимодействует с атомом другой молекулы, имеющим заряд отрицательный. Расстояние между атомами-участниками процесса должно оказаться меньше, чем сумма их радиусов. Выделяют два вида H-связей:
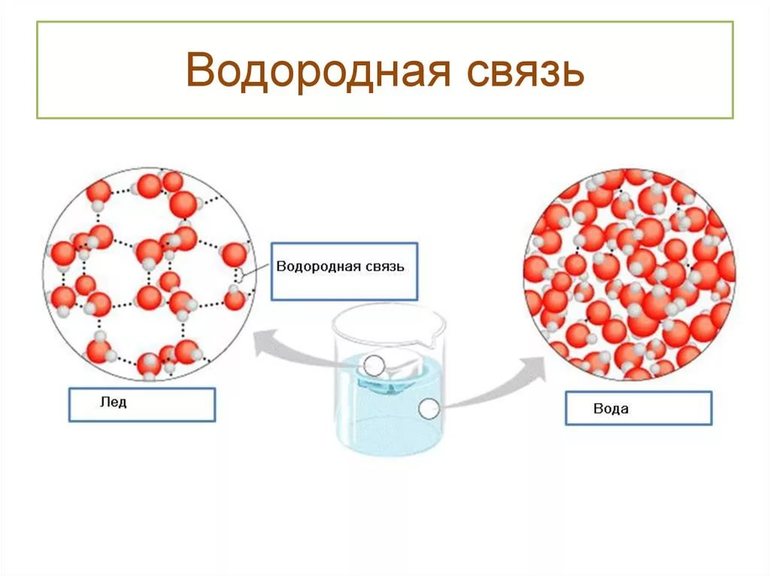
- Межмолекулярная. Возникает между различными молекулами веществ: для этого необходимо присутствие водорода и одного из элементов с хорошей способностью притягивать электроны других атомов. Высокая электроотрицательность фтора (F), кислорода (O), азота (N), хлора (Cl) и серы (S) служит этому надёжной поддержкой. Общие пары взаимодействующих электронов смещаются к атомам отрицательно заряженных элементов, а положительные электрические заряды водорода концентрируются в малых объёмах. Протоны взаимодействуют с электронными парами соседних атомов, что приводит к их обобществлению.
- Внутримолекулярная. Образуется в пределах одной молекулы, для чего в ней наряду с положительно заряженными атомами водорода должны присутствовать отрицательно поляризованные группы. Явление обнаруживается в природе у многоатомных спиртов, белков, углеводов и ряда других органических соединений.
Энергия H-связи обладает низкими прочностными характеристиками: она в несколько раз ниже, чем у остальных подобных взаимодействий. Это позволяет ей существовать промежуточным звеном между основными химическими связями (ковалентной, ионной и металлической) и силами притяжения и отталкивания Ван-дер-Ваальса, стремящимися удержать частицы в твёрдом или жидком состоянии. Кристаллические решётки с молекулами в узлах — характерная особенность веществ с водородной связью. Примеры можно привести различные:

- вода H2O в виде льда;
- кристаллы йода I;
- хлор Cl;
- бром Br;
- диоксид углерода CO2 в форме «сухого льда»;
- твёрдый аммиак NH3;
- конденсированная органика (метан CH4, бензол C6H6, фенол C6H5OH, нафталин C10H8, различные белки).
Механизм образования водородной связи считается смешанным — одновременно электростатическим и донорно-акцепторным. Решающая роль в этом принадлежит повышению электроотрицательности одного атома (A), позволяющей оттягивать в свою сторону электронную пару другого атома (H), принимающего участие в этом взаимодействии. В результате:
- первый атом приобретает частично отрицательный заряд (d-);
- второй участник заряжается положительно (d+);
- происходит поляризация химической связи (Аd-) — (Hd+).
Образовавшиеся атомы водорода, заряд которых частично положителен, обладают способностями притягивать другие молекулы, содержащие электроотрицательные группы. Эти электростатические взаимодействия и обуславливают появление Н-связей, для формирования которых необходимы три обязательных элемента:
- атом-донор протона;
- атом-акцептор протона;
- атом водорода Н.
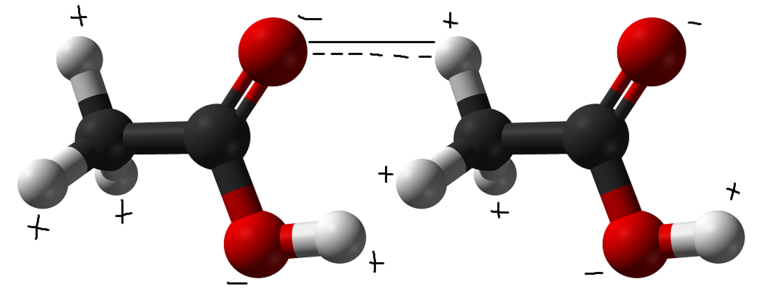
Такое донорство в обычных условиях никогда не осуществляется на все 100%. Атом-донор остается химически связанным с водородом. Графически это обозначается в виде линии из точек, указывающей, что сила взаимодействия слабее ковалентной связи. Схема записи структуры выглядит следующим образом: Б ··· Нd+ — Аd-.
Только три химических элемента полностью проявляют донорские способности, и их атомы поставляют протоны для образования Н-связей: азот (N), кислород (O) и фтор (F). В атомах-акцепторах недостатка не наблюдается. Низкомолекулярным соединениям H-связь придаёт способность в обычных условиях иметь жидкое агрегатное состояние, как это происходит у этанола (C2H5OH), метанола (CH3OH) и воды (H2O), или становиться сжижающимися при охлаждении газами — аммиаком (NH3) и гидрофторидом (HF).
Ионная связь
Самым простым предположением о природе химической связи атомов в молекуле является гипотеза о том, что между вешними электронами появляются силы взаимодействия электрической природы. При этом обязательным условием устойчивости молекулы в таком случае будет существование у двух атомов, которые взаимодействуют, электрических зарядов противоположного знака. Данный тип химической связи реализуется только в части молекул. При этом атомы, вступающие во взаимодействие, превращаются в ионы. Один из атомов присоединяет к себе один или несколько электронов и становится отрицательным ионом, при этом другой атом, отдавший электроны становится положительным ионом.
Ионная связь аналогична силам притяжения между зарядами противоположных знаков. Так, например, положительно заряженный ион натрия (${Na}^+$) притягивается к отрицательно заряженному иону хлора (${Cl}^-$), при этом образуется молекула NaCl.
Ионную связь называют еще гетерополярной (гетеро — разный). Молекулы, в которых реализуется ионный тип связи, называют ионными или гетерополярными молекулами.
При помощи одной ионной связи не удается объяснить структуры всех молекул. Так, невозможно понять, почему образуют молекулу два нейтральных атома водорода. Из-за одинаковости атомов водорода нельзя считать, что один ион водорода несет положительный заряд, а другой отрицательный. Связь, подобная связи в молекуле водорода (между нейтральными атомами) объяснима только в рамках квантовой механики. Она называется ковалентной связью.






























