Химические свойства
Отдельно отметим значение углекислого газа в фотосинтезе. Коротко эту реакции можно описать следующим образом:
Фотосинтез — химический процесс образования органических веществ и кислорода зелеными растениями из углекислого газа, под действием солнечного света.
Рисунок процесса фотосинтез Источник
Угольная кислота
Угольная кислота образуется при растворении оксида углерода (IV) в воде. А если быть еще точнее, то раствор углекислого газа и является угольной кислотой. Очень нестабильная кислота, после получения сразу разлагается на воду и газ.
Реакция разложения угольной кислоты:
Угольная кислота взаимодействуя с щелочами. Образует средние (соли, в состав которых входят металлический химический элемент и кислотный остаток) и кислые соли (в состав которых, кроме металлического химического элемента и кислотного остатка, входят атомы водорода) угольной кислоты. Последние называют гидрокарбонатами, первые – карбонаты.
Такие понятия, встречаемые в природе и в повседневной жизни, как временная жесткость воды и постоянная жесткость объясняется наличием в воде гидрокарбонатов кальция и магния и другими солями этих же элементов. Общая жесткость воды определяется суммой постоянной и временной жесткости.
Устранить жесткость воды можно различными содами. Например, кальцинированной содой (Na2CO3), т.е. карбонатом натрия, или же пищевой содой (NaHCO₃).Так же в быту для борьбы с накипью используют лимонную кислоту.
Если, к примеру, мы хотим очистить чайник от накипи, то зальем в него воды, добавим немного соды или лимонной кислоты, на выбор. Прокипятим и тщательно промоем. Не рекомендуется использовать уксус, т.к. он слишком летуч при кипячении и в воздухе окажутся вредные пары.
И чем жесткость выше, тем больше содержания в воде солей кальция и магния, а значит при кипячении такой воды образуется большое количество накипи. Накипь, систематически попадающая в организм, вредна. Она откладывается в организме человека, отрицательно влияя на функциональность органов и здоровье в целом. Так же этот процесс уменьшает срок службы бытовых электроприборов. Например, стиральных машин.
Накипь в чайнике
Оксид кремния (IV)
Данный оксид известен как кремнезём SiO2. Диоксид кремния является песком, содержание в котором кремния прямо влияет на свойства песка, улучшая их. Вещество твердое, плохо растворяется в воде, тугоплавкое. Отличительной особенностью можно назвать немолекулярное строение.
В естественной природной среде оксид данный встречается в виде песка, кварца и горного хрусталя, а также входит в состав глины и многих других элементов.
Данный оксид является кислотным, и при его взаимодействии с щелочами и амфотерными оксидами образуются силикаты, соли кремневой кислоты. Не реагирует с водой.
Кремневая кислота – это одна из слабых кислот. А слабыми называют кислоты, плохо растворяющиеся в воде.Нагревание разлагает эту кислоту на воду и диоксид кремния (SiO₂).
Силикаты — это соли кремниевой кислоты. Природные силикаты являются сложными соединениями. Среди них растворимы в воде только соли калия и натрия. Соли калия и натрия еще называют растворимыми стеклами, а их раствор – жидким стеклом.
Природные силикаты, это варианты соединения кремния с кислородом и другими элементами, среди которых: натрий, магний, кальций, алюминий, литий, бор, железо, калий, водород и т.д. Кристаллические решетки данной группы соединений составлены из тетраэдров кремния и кислорода, в соотношении 1:4 соответственно. И именно на основе этих комбинаций происходит следующая классификация типов силикатов.
Таблица классификация силикатов
Стекло – материал, активно используемый в быту. По своим свойствам хрупкий и прозрачный. Получают при варке сырьевой смеси (шихты) из песка, соды и известняка в специально приспособленных печах.
Процесс производства стекловолокна Источник
Вывод
Углерод и кремний уникальные элементы. Очень значимые как в жизни человека, так и в природе. Оба элемента очень распространены на Земле. Углерод составляет основу органических соединений, а значит является основой «живого» на Земле. Так же сам углерод в чистом виде, а точнее его аллотропная модификация алмаз, прослыли «самым твёрдым» веществом на нашей планете!
Кремний — основа большинства неорганических соединений, а содержание его в земной коре, в виде оксида, составляет 12%. Растениям атомы данного элемента придают особу прочность, входя в состав. Благодаря чему последние растут вверх, а не расползаются по земле.
Соединения этих элементов тоже очень значимы. Например, соединения кремния получили широкое применение в силикатной промышленности. А соединения углерода очень востребованы как топливо.
2.1.2 Степень окисления +4
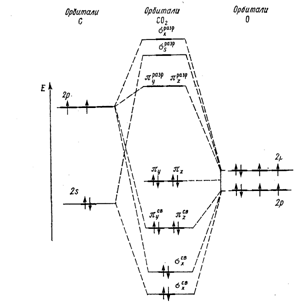
Диоксид углерода С02 (углекислый газ). Молекула С02
линейна. Энергетическая схема образования орбиталей молекулы С02
приведена на рис.2. Оксид углерода (IV) может взаимодействовать с
аммиаком по реакции.
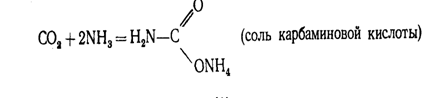
При нагревании этой соли получают ценное удобрение — карбамид СО (МН2)
2:
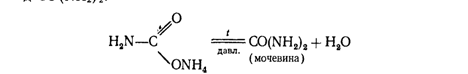
Мочевина разлагается водой
CO (NH2) 2+2HaO= (МН4) 2СОз.
В технике оксид СО2
получают разложением карбоната кальция или гидрокарбоната натрия:
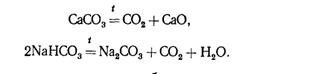
В лабораторных условиях его
обычно получают по реакции (в аппарате Киппа)
СаСОз+2НС1=СаС12+С02+Н20.
Важнейшими производными С02 являются слабая угольная кислота Н2СОз
и ее соли: MI2СОз и MIНСОз (карбонаты и
гидрокарбонаты соответственно).
Большинство карбонатов
нерастворимо в воде. Растворимые в воде карбонаты подвергаются значительному
гидролизу:
COз2-+H20 COз-+OH — (I ступень).
Из-за полного гидролиза из водных растворов нельзя выделить карбонаты Cr3+,
ai3+, Ti4+,
Zr4+ и др.
Практически важными являются Ка2СОз (сода), К2СОз (поташ)
и СаСОз (мел, мрамор, известняк). Гидрокарбонаты в отличие от карбонатов растворимы
в воде. Из гидрокарбонатов практическое применение находит NaHCО3 (питьевая
сода). Важными основными карбонатами являются 2СиСОз-Си (ОН) 2, РЬСО3
Х ХРЬ (ОН) 2.
Свойства галогенидов углерода приведены в табл.6. Из галогенидов углерода
самое большое значение имеет-бесцветная, достаточно токсичная жидкость. В
обычных условиях ССІ4химически
инертен. Его применяют как невоспламеняющийся и негорючий растворитель смол,
лаков, жиров, а также для получения фреона CF2CІ2 (Ткип=
303 К):
![]()
Другой используемый в практике
органический растворитель — сероуглерод CSa (бесцветная, летучая жидкость с
Ткип=319 К) – реакционно способное вещество:
CS2+302=C02+2S02+258
ккал/моль,
CS2+3Cl2=CCl4-S2Cl2,CS2+2H2
0==C02+2H2S, CS2+K2S=K2CS3
(соль тиоугольной кислоты Н2СSз).
Пары сероуглерода ядовиты.
3.1 Кислородные соединения кремния
Важнейшим кислородным соединением кремния является диоксид кремния SiO2 (кремнезем), имеющий несколько кристаллических модификаций.
Низкотемпературная модификация (до
1143 К) называется кварцем. Кварц обладает пьезоэлектрическими свойствами.
Природные разновидности кварца: горный хрусталь, топаз, аметист.
Разновидностями кремнезема являются халцедон, опал, агат,. яшма, песок.
Кремнезем химически стоек; на него действуют лишь фтор, плавиковая
кислота и растворы щелочей. Он легко переходит в стеклообразное состояние (кварцевое
стекло). Кварцевое стекло хрупко, химически и термически весьма стойко.
Отвечающая SiO2 кремниевая кислота не имеет определенного состава.
Обычно кремниевую кислоту записывают в виде xH2O-ySiO2. Выделены кремниевые кислоты: H2SiO3 (H2O-SiO2) — метакремниевая (три-оксокремниевая), H4Si04 (2H20-Si02)
— ортокремниевая (тетра-оксокремниевая), H2Si2O5 (H2O * SiO2) — диметакремниевая.
Кремниевые кислоты — плохо растворимые вещества. В соответствии с менее
металлоидным характером кремния по сравнению с углеродом H2SiO3 как электролит слабее Н2СОз.
Отвечающие кремниевым кислотам соли-силикаты-в воде нерастворимы (кроме
силикатов щелочных металлов). Растворимые силикаты гидролизуются по уравнению
2SiOз2-+H20=Si2O52-+20H-.
Концентрированные растворы растворимых силикатов называют жидким стеклом.
Обычное оконное стекло-силикат натрия и кальция-имеет состав Na20-CaO-6Si02.
Его получают по реакции
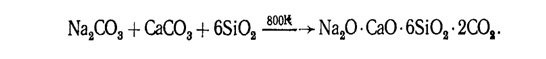
Известно большое разнообразие силикатов (точнее, оксосиликатов). В
строении оксосиликатов наблюдается определенная закономерность: все состоят из
тетраэдров Si04, которые через атом кислорода соединены друг с
другом. Наиболее распространенными сочетаниями тетраэдров являются (Si2O76-),
(Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), которые как структурные единицы могут объединяться в цепочки, ленты,
сетки и каркасы (рис 4).
Важнейшими природными силикатами являются, например, тальк (3MgO * H20-4Si02)
и асбест (SmgO*H2O*SiO2). Как и для SiO2, для
силикатов характерно стеклообразное (аморфное) состояние. При управляемой
кристаллизации стекла можно получить мелкокристаллическое состояние (ситаллы).
Ситаллы характеризуются повышенной прочностью.
Кроме силикатов в природе широко распространены алюмосиликаты.
Алюмосиликаты — каркасные оксосиликаты, в которых часть атомов кремния заменена
на трехвалентный Аl; например Na12 [ (Si, Al) 04]
12.
Для кремниевой кислоты характерно коллоидное состояние при
воздействии на ее соли кислот H2SiO3
выпадает не сразу. Коллоидные растворы кремниевой кислоты (золи) при
определенных условиях (например, при нагревании) можно перевести в прозрачную,
однородную студнеобразную массу-гель кремниевой кислоты. Гели —
высокомолекулярные соединения с пространственной, весьма рыхлой структурой,
образованной молекулами Si02, пустоты которой заполнены молекулами H2O. При обезвоживании гелей кремниевой кислоты получают силикагель —
пористый продукт, обладающий высокой адсорбционной способностью.
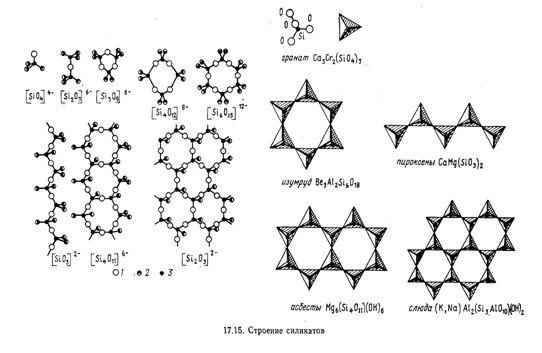
Рисунок 4. Строение силикатов.
Почему нет «кремниевой» жизни
Почему же тогда на Земле нет форм жизни, основанных на кремнии, особенно учитывая, что кремний примерно в 135 раз более распространен, чем углерод на нашей планете?
Углерод имеет более прочные связи
Ответ заключается в том, что, хотя кремний имеет преимущество в интенсивном нагревании, углерод преобладает в типичных средах на поверхности Земли или вблизи нее. То есть при так называемой комнатной температуре 20 градусов углерод связывается с другими атомами более прочно, и особенно с другими атомами. В частности, углерод с его 4 непарными внешними электронами может образовывать плотные химические связи, разделяя эти электроны с другими элементами.
Аналогично, хотя кремний является возможной альтернативой углероду, чтобы понять, почему он не так прочен как углерод, рассмотрим следующее.
Кремний, расположенный чуть ниже углерода в той же колонке периодической таблицы элементов, также имеет 4 неспаренных электрона на своей внешней орбите. Увы, как отмечалось выше, кремний не может связываться с другими атомами так же, как углерод. Это происходит потому, что 4 неспаренных электрона атома углерода обычно находятся на его второй орбитали и поскольку 8 — это максимальное число электронов, допустимое на второй орбитали любого атома, эта орбиталь становится полной и завершенной, когда углерод связывается с другими атомами со всех 4 сторон.
Соответственно, химическая связь углерода является одной из самых сильных.
Напротив, 4 неспаренных электрона кремния обычно находятся на его третьей орбитали и здесь максимальное число электронов, разрешенных на третьей орбитали любого атома, составляет 18. Хотя кремний обычно может иметь атомы, связанные с каждой из его 4 сторон, так же, как углерод, Кремниевая связь не так сильна, как углеродная связь, потому что внешняя орбиталь кремния часто не имеет полного набора электронов, даже когда она связана с другими атомами. Как правило, углеродные связи вдвое прочнее кремниевых.
Еще более важно то, что углерод наиболее сильно связан с другими атомами углерода. Это особенно верно для алмаза, который состоит из атомов углерода, связанных друг с другом
На самом деле алмаз — самое твердое из известных веществ; твердость обусловлена большой прочностью связи. Кроме того, углеродные связи также не подвержены влиянию воды, что дает углероду еще одно преимущество в наиболее вероятной жидкой среде для жизни. Кремний, с другой стороны, не так хорошо связывается с другими атомами кремния, и совсем не хорошо в присутствии многих жидкостей. Цепи кремния особенно неустойчивы в воде; они распадаются на части.
Алмаз является самым твердым из известных веществ. Каждый атом, состоящий из чистых атомов углерода, прочно связан с 4 другими атомами.
Тот факт, что связь углерод-углерод сильнее, чем связь кремний-кремний, особенно при погружении в жидкость, является важным фактором, благоприятствующим жизни на основе этого элемента.
Образование сложных химических связей
Другая причина-нежелание кремния образовывать двойные и тройные связи, которые обычно придают еще большую прочность группе из двух или более атомов. Углерод создает сложный порядок соединения атомов элементов — химическое строение.
Кроме того углерод легко образует длинные цепи, и он распространен во всей Вселенной.
Реагирование кислорода и углерода
Третий аргумент в пользу углеродной жизни — высокое космическое изобилие кислорода. Когда C химически реагирует с O, в результате образуется углекислый газ CO2. Это газ и поэтому может легко сочетаться с другими соединениями; в нашем случае люди выдыхают углекислый газ после того, как вдыхаемый O реагирует с C в наших телах во время дыхания. Однако, когда кремний (Si) вступает в реакцию с O, в результате получается кварц (SiO2), который является твердым веществом, которое вряд ли легко взаимодействует с другими соединениями. Можете ли вы представить себе живых существ, выдыхающих кварцевые частички каждый раз, когда они делают вдох? Фотосинтез и дыхание основополагающая часть нашей жизни.
Поэтому нас не должно удивлять, что кремний не играет никакой биохимической роли на Земле, несмотря на его широкое распространение.
Химические свойства соединений углерода
1) Так как прочность монооксида углерода велика, то он вступает в химические реакции при высоких температурах. При значительном нагревании проявляются высокие восстановительные свойства монооксида углерода. Так, он вступает в реакцию с оксидами металлов:
CuO + CO => Cu + CO2
При повышенной температуре (700 °С) он воспламеняется в кислороде и горит голубым пламенем. По этому пламени можно узнать, что в результате реакции образуется углекислый газ:
CO + O2 => CO2
2) Двойные связи в молекуле диоксида углерода достаточно прочны. Для их разрыва требуется значительная энергия (525,6 кДж/моль). Поэтому диоксид углерода довольно инертен. Реакции, в которые он вступает, часто происходят при высоких температурах.
Диоксид углерода проявляет кислотные свойства в реакции с водой. При этом образуется раствор угольной кислоты. Реакция происходит обратимо.
Диоксид углерода как кислотный оксид реагирует со щелочами и основными оксидами. При пропускании углекислого газа через раствор щёлочи может образоваться либо средняя, либо кислая соль.
3) Угольная кислота обладает всеми свойствами кислот и взаимодействует со щелочами и основными оксидами.
Производство
Из-за редкости нахождения в природе муассанита карбид кремния, как правило, имеет искусственное происхождение. Простейшим способом производства является спекание кремнезёма с углеродом в графитовой электропечи Ачесона при высокой температуре 1600—2500 °C:
- SiO2 + 3C →1600−2500oC SiC + 2CO
Синтетические кристаллы SiC ~ 3 мм в диаметре
Чистота карбида кремния, образующегося в печи Ачесона, зависит от расстояния до графитового резистора в ТЭНе.
Кристаллы высокой чистоты бесцветного, бледно-жёлтого и зелёного цвета находятся ближе всего к резистору. На большем расстоянии от резистора цвет изменяется на синий или чёрный из-за примесей. Загрязнителями чаще всего являются азот и алюминий, они влияют на электропроводность полученного материала.
Кристаллы карбида кремния, полученные благодаря
Чистый карбид кремния можно получить с помощью так называемого , в котором порошкообразный SiC возгоняется в атмосфере аргона при 2500 °C и осаждается на более холодной подложке в виде чешуйчатых монокристаллов размерами до 2×2 см. Этот процесс даёт высококачественные монокристаллы, получающиеся из-за быстрого нагрева до высоких температур и в основном состоящие из 6H-SiC фазы. Улучшенный процесс Лели при участии индукционного нагрева в графитовых тиглях даёт ещё большие монокристаллы до 10 см в диаметре. Кубический SiC, как правило, выращивается с помощью более дорогостоящего процесса — химического осаждения паров.
Чистый карбид кремния также может быть получен путём термического разложения полимера полиметилсилана (SiCH3)n, в атмосфере инертного газа при низких температурах. Относительно CVD-процесса метод пиролиза более удобен, поскольку из полимера можно сформировать изделие любой формы перед запеканием в керамику.
Химические свойства кремния
Кремний может существовать, как и углерод в кристаллическом и аморфном состоянии и, также, как и в случае углерода, аморфный кремний существенно более химически активен, чем кристаллический.
Иногда аморфный и кристаллический кремний, называют его аллотропными модификациями, что, строго говоря, не совсем верно. Аморфный кремний представляет собой по сути конгломерат беспорядочно расположенных друг относительно друга мельчайших частиц кристаллического кремния.
Взаимодействие кремния с простыми веществами
неметаллами
При обычных условиях кремний ввиду своей инертности реагирует только со фтором:
С хлором, бромом и йодом кремний реагирует только при нагревании. При этом характерно, что в зависимости от активности галогена, требуется и соответственно различная температура:
Так с хлором реакция протекает при 340-420 о С:
С бромом – 620-700 о С:
С йодом – 750-810 о С:
Все галогениды кремния легко гидролизуются водой:
а также растворами щелочей:
Реакция кремния с кислородом протекает, однако требует очень сильного нагревания (1200-1300 о С) ввиду того, что прочная оксидная пленка затрудняет взаимодействие:
При температуре 1200-1500 о С кремний медленно взаимодействует с углеродом в виде графита с образованием карборунда SiC – вещества с атомной кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
С водородом кремний не реагирует.
металлами
Ввиду своей низкой электроотрицательности кремний может проявлять окислительные свойства лишь по отношению к металлам. Из металлов кремний реагирует с активными (щелочными и щелочноземельными), а также многими металлами средней активности. В результате такого взаимодействия образуются силициды:
Силициды активных металлов легко гидролизуются водой или разбавленными растворами кислот-неокислителей:
При этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния со сложными веществами
С водой кремний не реагирует даже при кипячении, однако аморфный кремний взаимодействует с перегретым водяным паром при температуре около 400-500 о С. При этом образуется водород и диоксид кремния:
Из всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной плавиковой кислотой:
Кремний растворяется в концентрированных растворах щелочей. Реакция сопровождается выделением водорода:
Открытие и начало производства
Повторение эксперимента Г. Д. Раунда
О ранних, не систематических и часто непризнанных синтезах карбида кремния сообщали Деспретз (1849), Марсден (1880) и Колсон (1882 год). Широкомасштабное производство начал Эдвард Гудрич Ачесон в 1893. Он запатентовал метод получения порошкообразного карбида кремния 28 февраля 1893. Ачесон также разработал электрическую печь, в которой карбид кремния создаётся до сих пор. Он основал компанию The Carborundum Company для производства порошкообразного вещества, которое первоначально использовалось в качестве абразива.
Исторически первым способом использования карбида кремния было использование в качестве абразива. За этим последовало применение и в электронных устройствах. В начале XX века карбид кремния использовался в качестве детектора в первых радиоприемниках. В 1907 году Генри Джозеф Раунд создал первый светодиод, подавая напряжение на кристаллы SiC и наблюдая за жёлтым, зелёным и оранжевым излучением на катоде. Эти эксперименты были повторены О. В. Лосевым в СССР в 1923 году.
Применение вещества
 Для промышленности наибольший интерес представляют электрофизические характеристики неметалла. Его монокристаллическая форма является непрямозонным полупроводником. Свойства его определяются примесями, что позволяет получать кристаллы кремния с заданными свойствами. Так, добавка бора, индия дает возможность вырастить кристалл с дырочной проводимостью, а введение фосфора или мышьяка – кристалл с электронной проводимостью.
Для промышленности наибольший интерес представляют электрофизические характеристики неметалла. Его монокристаллическая форма является непрямозонным полупроводником. Свойства его определяются примесями, что позволяет получать кристаллы кремния с заданными свойствами. Так, добавка бора, индия дает возможность вырастить кристалл с дырочной проводимостью, а введение фосфора или мышьяка – кристалл с электронной проводимостью.
- Кремний в буквальном смысле слова служит основой современной электротехники. Из него изготавливают транзисторы, фотоэлементы, интегральные схемы, диоды и так далее. Причем функциональность прибора определяет практически всегда только приповерхностный слой кристалла, что обуславливает весьма специфические требования именно к обработке поверхности.
- В металлургии технический кремний применяют и как модификатор сплавов – придает большую прочность, и как компонент – в , например, и как раскислитель – при производстве чугуна.
- Сверхчистый и очищенный металлургический составляют основу солнечной энергетики.
- Диоксид неметалла встречается в природе в очень разных формах. Его кристаллические разновидности – опал, агат, сердолик, аметист, горный хрусталь, нашли свое место в ювелирном деле. Не столь привлекательные внешне модификации – кремень, кварц, используются и в металлургии, и в строительстве, и в радиоэлектротехнике.
- Соединение неметалла с углеродом – карбид, применяется и в металлургии, и в приборостроении, и в химической промышленности. Он является широкозональным полупроводником, отличается высокой твердостью – 7 по шкале Мооса, и прочностью, что и позволяет применять его в качестве абразивного материала.
- Силикаты – то есть, соли кремниевой кислоты. Неустойчивы, легко разлагаются под действием температуры. Примечательность их в том, что они образуют многочисленные и разнообразные соли. А вот последние являются основой при производстве стекла, керамики, фаянса, хрусталя, и . Можно смело сказать, что современное строительство зиждется на разнообразных силикатах.
- Стекло представляет здесь наиболее интересный случай. Основой его служат алюмосиликаты, но ничтожные примеси других веществ – обычно оксидов, придают материалу массу разных свойств, в том числе и цвет. – , фаянс, фарфор, по сути, имеет ту же формулу, хотя и с другим соотношением компонентов, и ее разнообразие тоже поразительно.
- Неметалл обладает еще одной способностью: образует соединения по типу углеродных, в виде длинной цепочки из атомов кремния. Такие соединения носят название кремнийорганических. Сфера их применения не менее известна – это силиконы, герметики, смазки и так далее.
Кремний – очень распространенный элемент и имеет необыкновенно большое значение в очень многих сферах народного хозяйства. Причем активно используется не только само вещество, но все его разнообразные и многочисленные соединения.
Данное видео расскажет о свойствах и применении кремния:
Кремний в свободном виде был выделен в 1811 Ж.Гей-Люссаком и Л.Тенаром при пропускании паров фторида кремния над металлическим калием, однако он не был описан ими как элемент. Шведский химик Й.Берцелиус в 1823 дал описание кремния, полученного им при обработке калиевой соли K 2 SiF 6 металлическим калием при высокой температуре. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе c др.-греч. krhmnoz
— «утес, гора».
Нахождение в природе, получение:
В природе кремний находится в виде диоксида и силикатов различного состава. Природный диоксид кремния встречается преимущественно в форме кварца, хотя существуют и другие минералы — кристобалит, тридимит, китит, коусит. Аморфный кремнезем встречается в диатомовых отложениях на дне морей и океанов — эти отложения образовались из SiO 2 , входившего в состав диатомовых водорослей и некоторых инфузорий.
Свободный кремний может быть получен прокаливанием с магнием мелкого белого песка, который по химическому составу является почти чистым оксидом кремния, SiO 2 +2Mg=2MgO+Si. В промышленности кремний технической чистоты получают, восстанавливая расплав SiO 2 коксом при температуре около 1800°C в дуговых печах. Чистота полученного таким образом кремния может достигать 99,9% (основные примеси — углерод, металлы).
2.3.4. Химические свойства углерода и кремния.
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем. 1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
а также с кремнием при температуре 1200-1300 о С:
Окислительные свойства углерод проявляет по отношению к металлам. Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
Карбиды активных металлов гидролизуются водой:
а также растворами кислот-неокислителей:
При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
Кремниевая кислота и силикаты
Как уже упоминалось, минералы, основу которых составляет оксид кремния, составляют около 12 % земной коры. К ним относятся песок и кварц, горный хрусталь и полудрагоценные камни (яшма, агат и др.). Песок — это тугоплавкое вещество, при остывании расплава которого образуется кварцевое стекло. Обычное стекло образуется при сплавлении этого оксида с карбонатами кальция и натрия.
Оксид кремния относится к кислотным оксидам, поскольку кислоты не действуют на этот оксид, а со щелочами и основными оксидами он образует соли.
Задание 13.11. Составьте уравнения реакций оксида кремния с гидроксидом кальция и оксидом магния. Вспомните, где происходят эти процессы (см. урок 9).
Но с водой этот кислотный оксид не реагирует, так как соответствующий гидроксид (кислота) нерастворим в воде. Кремниевая кислота H2SiO3– аморфное бесцветное вещество, которое легко теряет влагу и превращается в пористый силикагель. Силикагель, как и активированный уголь, используется в качестве адсорбента*.
Кремниевые кислоты образуются под действием любой кислоты на раствор силиката. При этом образуется студенистый осадок:
![]()
Эту реакцию можно считать качественной на силикаты, потому что при действии кислот на различные соли только силикаты дают осадок кислоты.
Концентрированный раствор силикатов калия и натрия называется «жидкое стекло» и применяется в качестве канцелярского клея. Этот клей под действием углекислоты воздуха застывает:
![]()
Растворимые силикаты сильно гидролизуются.
Задание 13.12. Составить уравнение реакции гидролиза силиката, определить реакцию среды.
Создавая щелочную среду и связывая ионы кальция и магния, эти силикаты облегчают процессы стирки и входят в состав некоторых моющих средств. Если растворимым стеклом пропитать текстиль или древесину, то они не возгораются. Но не всякий текстиль выдерживает такую обработку: сильно щелочная среда разрушает материал.
Если внимательно посмотреть по сторонам, то искусственно полученные силикаты окружают нас со всех сторон. Это:
- керамические изделия (вазы, чашки, сковородки с керамическим покрытием, к которому не пригорает пища),
- кирпичи, стекло, цемент и бетон, другие строительные материалы;
- изделия из фарфора и фаянса (чашки и тарелки).
Задание. Найдите у себя дома несколько предметов, которые выпускает силикатная промышленность.
Проверь себя
Задание 1.Сколько неспаренных электронов содержит атом кремния в возбужденном электронном состоянии?
- 1 электрон;
- 2 электрона;
- 3 электрона;
- 4 электрона.
Задание 2.С каким из следующих простых веществ не реагирует кремний?
- Углерод;
- Бром;
- Фосфор;
- Кислород.
Задание 3.С каким из перечисленных веществ будет реагировать диоксид кремния?
- Карбонат натрия;
- Сульфат калия;
- Хлорид рубидия;
- Ортофосфат кальция.
Задание 4.Какое свойство отличает кремниевую кислоту от других кислот?
- Она содержит атомы кислорода;
- При комнатной температуре кремниевая кислота — жидкость;
- Она нерастворима в воде;
- Она проявляет амфотерные свойства.
Задание 5.Как называются бинарные соединения кремния и металлов?
- Силаны;
- Силициды;
- Силикаты;
- Силоксаны.
Ответы: 1. — 4; 2. — 3; 3. — 1; 4. — 3; 5. — 2.





























